Một hợp chất có % khối lượng : 82,35% N; 17,65% H
a) Tìm CTHH biết tỉ khối của nó với h2 là 8,5
b) Tìm số phân tử chất đó có trong 3,36 lít khí
HÓA HỌC 8
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(m_N=\dfrac{17.82,35}{100}=14\left(g\right)\Rightarrow n_N=\dfrac{14}{14}=1\left(mol\right)\)
\(m_H=\dfrac{17,65.17}{100}=3\left(g\right)\Rightarrow n_H=\dfrac{3}{1}=3\left(mol\right)\)
=> CTHH: NH3
\(Đặt:N_xH_y\left(x,y:nguyên,dương\right)\\ x=\dfrac{82,35\%.17}{14}=1\\ y=\dfrac{17,65\%.17}{1}=3\\ \Rightarrow CTHH:NH_3\)

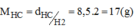
Khối lượng của nito trong 1 mol hợp chất:
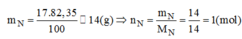
Khối lượng của hidro trong 1 mol hợp chất:
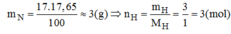
Vậy trong hợp chất có 1 mol nguyên tử N và 3 mol nguyên tử H.
→ Công thức hóa học đơn giản của hợp chất là N H 3

MX = 8,5.2 = 17 (g/mol)
\(m_N=\dfrac{17.82,35}{100}=14\left(g\right)=>n_N=\dfrac{14}{14}=1\left(mol\right)\)
\(m_H=\dfrac{17,65.17}{100}=3\left(g\right)=>n_H=\dfrac{3}{1}=3\left(mol\right)\)
=> CTHH:NH3
\(M_X=8,5.2=17(g/mol)\)
Trong 1 mol X: \(\begin{cases} n_N=\dfrac{17.82,35\%}{14}=1(mol)\\ n_H=\dfrac{17.17,65\%}{1}=3(mol) \end{cases}\)
Vậy \(CTHH_X:NH_3\)

MX = 8,5.2 = 17 (g/mol)
=> \(\left\{{}\begin{matrix}m_N=17.82,35\%=14=>n_N=\dfrac{14}{14}=1\left(mol\right)\\m_H=17.17,65\%=3=>n_H=\dfrac{3}{1}=3\left(mol\right)\end{matrix}\right.\)
=> CTHH: NH3

Trong 0,5 mol N H 3 có: 0,5 mol nguyên tử N
0,5x3=1,5 mol nguyên tử H.

Gọi CTC: NxHy
Theo đề bài, ta có:
\(\)\(d_{\dfrac{hc}{H_2}}\) = \(\dfrac{M_{hc}}{M_{H_2}}=8,5\)
=> \(M_{hc}=8,5.2=17\) ( g/ mol )
\(m_N=\dfrac{17.82,35\%}{100\%}\approx14g\)
\(m_H=\dfrac{17.17,65\%}{100\%}\approx3g\)
\(n_N=\dfrac{14}{14}=1mol\)
\(n_H=\dfrac{3}{1}=3mol\)
=> CTHH: NH3