Tính toán và trình bày cách pha chế 0,5 lít dd H2SO4 1M từ dd H2SO4 98% có D= 1,84 g/ml
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Lấy khoảng 100 – 120 ml nước cất cho vào bình thể tích 200 ml có chia vạch, sau đó cho từ từ 20 gam dung dịch H2SO4 đặc hoặc đong 10,87 ml dung dịch H2SO4, đợi dung dịch H2SO4 thật nguội.
Tiếp theo đong 40 ml dung dịch HCl 5M thêm vào bình, cuối cùng thêm nước cất vào cho đến vạch 200 ml.

\(V_1:\) Thể tích H2SO4 1 M
\(V_2:\) Thể tích H2SO4 2 M
\(V_{H_2SO_4}=V_1+V_2=0.05\left(l\right)\left(1\right)\)
\(n_{H_2SO_4}=V_1+2V_2=0.05\cdot1.5=0.075\left(mol\right)\left(2\right)\)
\(\left(1\right),\left(2\right):V_1=0.025,V_2=0.025\)
Đong lấy 25 ml dung dịch H2SO4 1M và 25 ml dung dịch H2SO4 2M cho vào bình tam giác, lắc đều, ta được 50 ml dung dịch H2SO4 1,5M.

\(m_{H_2SO_4}=\dfrac{150.20}{100}=30\left(g\right)\\ \rightarrow m_{ddH_2SO_4\left(98\%\right)}=\dfrac{30.100}{98}=30,6\left(g\right)\\ \rightarrow m_{H_2O\left(thêm\right)}=150-30,6=119,4\left(g\right)\)
\(\rightarrow V_{H_2O}=\dfrac{119,4}{1}=119,4\left(ml\right)\)
Các pha chế: Rót từ 30,6 g dd H2SO4 đặc (98%) và cốc có đựng sẵn 119,4 ml nước rồi khuấy đều, nếu làm nhược lại sẽ nguy hiểm

* Số mol của H 2 S O 4 cần để pha chế 500ml dung dịch H 2 S O 4 1M:
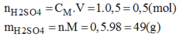
* Khối lượng H 2 S O 4 98% có chứa 49g H 2 S O 4 :
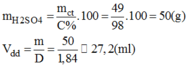
* Cách pha chế: Đổ khoảng 400ml nước cất vào cốc có chia độ có dung tích khoảng 1lit. Rót từ từ 27,2ml H 2 S O 4 98% vào cốc khuấy đều. Sau đó thêm dần dần nước cất vào cốc cho đủ 500ml. ta pha chế được 500ml dung dịch H 2 S O 4 1M.

n H2SO4 = 0,5.0,1 = 0,05(mol)
m H2SO4 = 0,05.98 = 4,9(gam)
m dd H2SO4 = \(\dfrac{4,9}{98\%}\) = 5(gam)
V dd H2SO4 = \(\dfrac{5}{1,83}\) = 2,7322(cm3)

Tính toán :
\(n_{H_2SO_4} = 2.1 = 2(mol)\\ H_2SO_4.3SO_3 + 3H_2O \to 4H_2SO_4\\ n_{oleum} = \dfrac{1}{4}n_{H_2SO_4} = 0,5(mol)\\ m_{oleum} = 0,5.338 = 169(gam)\)
Pha chế :
Cân lấy 169 gam oleum H2SO4.3SO3 cho vào cốc dung tích 5 lít có chia vạch
Thêm từ từ nước vào cốc cho đến khi chạm vạch 2 lít thì dừng lại khuấy đều. Ta được 2 lít dung dịch H2SO4 1M

\(n_{H_2SO_4}=1.0,5=0,5(mol)\\ \Rightarrow m_{H_2SO_4}=0,5.98=49(g)\\ m_{H_2SO_4(96\%)}=\dfrac{100.49}{96}\approx 51,04(g)\\ \Rightarrow V_{dd_{H_2SO_4(96\%)}}=\dfrac{51,04}{1,83}\approx 27,89(l)\)
Pha chế:
Đổ khoảng 400 ml nước cất vào cốc chia độ có dung tích 1 lít. Rót từ từ \(27,89ml\) \(H_2SO_4\) \(96\%\) vào cốc, khuấy đều. Sau đó thêm dần dần nước cất vào cốc cho đủ 500 ml. Ta đã pha chế được 500 ml dung dịch \(H_2SO_4\) 1M.
\(n_{H_2SO_4}=0.5\cdot1=0.5\left(mol\right)\)
\(m_{dd_{H_2SO_4}}=\dfrac{0.5\cdot98\cdot100}{98}=50\left(g\right)\)
\(V_{dd_{H_2SO_4}}=\dfrac{50}{1.84}=27.17\left(ml\right)=0.02717\left(l\right)\)
Sorry chút nhé , đọc thiếu đề.
Cách pha chế :
- Đong lấy 100 ml nước cất cho vào bình đựng có dung tích 1 (l) , cho từ từ 50 (g) dung dịch H2SO4 vào cốc. Rót từ từ nước cất đến vạch 0.5 (l) thì dừng lại.