Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn D
Nguyên tố R có cấu hình electron lớp ngoài cùng là ns2np4 → R thuộc nhóm VIA.
→ Công thức oxit cao nhất của R là RO3; công thức hợp chất khí với H của R là RH2.

Chọn C
Oxit cao nhất của R có dạng R O 3 . Theo bài ra có:
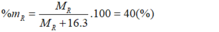
→ R = 32. Vậy R là lưu huỳnh (S).

Chọn B
R có 4 electron lớp ngoài cùng, e cuối cùng điền vào phân lớp np → R thuộc nhóm IVA
→ Hợp chất khí với hiđro và oxit cao nhất của R lần lượt là R O 2 , R H 4 .
Ta có:
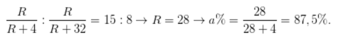
Hợp chất của một nguyên tố có công thức RH2 . Oxit cao nhất của R chứa 40% khối lượng R . Vậy R là ?

CTHH: RH2 => R có hoá trị cao nhất là VI
=> CTHH R hoá trị cao nhất với O: RO3
\(V\text{ì}:\%m_{\dfrac{R}{RO_3}}=40\%\\ \Leftrightarrow\dfrac{M_R}{M_R+48}=40\%\\ \Leftrightarrow M_R-0,4M_R=19,2\\ \Leftrightarrow M_R=\dfrac{19,2}{0,6}=32\left(\dfrac{g}{mol}\right)\\ \Rightarrow R:L\text{ưu}.hu\text{ỳ}nh\left(S=32\right)\)

Đáp án D
R có 6e lớp ngoài cùng, hóa trị cao nhất với oxi = 6, hidro = 2.