Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
R có 6e lớp ngoài cùng, hóa trị cao nhất với oxi = 6, hidro = 2.

b) CT hợp chất của R với hidro là RH3
Có \(\dfrac{3}{M_R+3}.100\%=8,82\%=>M_R=31\left(P\right)\)
CT oxit cao nhất: P2O5
CT hidroxit: H3PO4
c) CT oxit cao nhất: RO2
\(\dfrac{32}{M_R+32}.100\%=53,3\%\) => MR = 28 (Si)

Chọn B
R có 4 electron lớp ngoài cùng, e cuối cùng điền vào phân lớp np → R thuộc nhóm IVA
→ Hợp chất khí với hiđro và oxit cao nhất của R lần lượt là R O 2 , R H 4 .
Ta có:
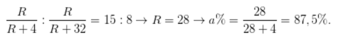

Công thức oxit cao nhất : \(RO_2\)
⇒ R thuộc hóa trị IV
Ta có: hóa trị oxit cao nhất + hóa trị trong hợp chất với hidro = 8
⇔ hóa trị trong hợp chất với hidro là IV
Công thức trong hợp chất với hidro : \(RH_4\)
Ta có: %H = \(\dfrac{4M_H.100}{M_R+4M_H}\)
⇔ 25 = \(\dfrac{400}{M_R+4}\)
⇔ \(25M_R+100=400\)
⇔ \(M_R\) = 12 (g/mol)
Vậy R là Cacbon (C)
Cấu hình electron: \(1s^22s^22p^2\)
Công thức hợp chất với hidro: RH4
Ta có: %H=25%
%R= 75%
\(\dfrac{M_R}{4M_H}=\dfrac{75}{25}\)
\(\Leftrightarrow\dfrac{M_R}{4\times1}=\dfrac{75}{25}\)
\(\Rightarrow M_R=12\)
Suy ra R là C (Z=6)
cấu hình e: 1s22s22p2

Chọn D
Nguyên tố R có cấu hình electron lớp ngoài cùng là ns2np4 → R thuộc nhóm VIA.
→ Công thức oxit cao nhất của R là RO3; công thức hợp chất khí với H của R là RH2.