Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Số mol ankin: 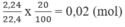
R - C ≡ C H + A g N O 3 + N H 3 → R - C ≡ C - A g ↓ + N H 4 N O 3
0,02 mol 0,02 mol
Khối lượng 1 mol
R
-
C
≡
C
-
A
g
là: 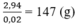
R - C ≡ C - A g = 147 ⇒ R = 147 - 24 - 108 = 15
R là C H 3 ; ankin là C H 3 - C ≡ C H (propin)
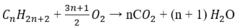
C O 2 + C a ( O H ) 2 → C a C O 3 ↓ + H 2 O
Số mol ankan là 0,08 mol
Số mol C O 2 = số mol C a ( O H ) 2 = 0,16 (mol)
Suy ra 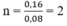
Vậy ankan là C 2 H 6
Khối lượng hỗn hợp A là: 0,02 x 40 + 0,08 x 30 = 3,2 (g)
Về khối lượng,
C
3
H
4
chiếm 
và C 2 H 6 chiếm 75%.

Số mol
O
2
: 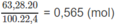
Số mol C O 2 = số mol C a C O 3 = 0,36 (mol).
1. Trong 0,36 mol C O 2 , khối lượng cacbon: 0,36 x 12 = 4,32 (g) và khối lượng oxi: 0,36 x 32 = 11,52 (g).
Khối lượng oxi trong nước là: 0,565 x 32,0 - 11,52 = 6,56 (g).
Khối lương hiđro (trong nước): 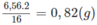
Khối lượng M = khối lượng C + khối lượng H = 4,32 + 0,82 = 5,14 (g)
2. Khi đốt 1 mol ankan, số mol H 2 O tạo ra nhiều hơn số mol C O 2 là 1 mol. Khi đốt hỗn hợp M, số mol H 2 O nhiều hơn số mol C O 2 :
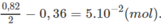
Vậy hỗn hợp M có 5. 10 - 2 mol ankan.
Khối lượng trung bình của 1 mol ankan:
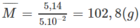
14n + 2 < 102,8 < 14n + 30
⇒ 5,20 < n < 7,20
Đến đây có thể tìm được công thức phân tử và phần trăm khối lượng từng chất như ở cách thứ nhất.

CTPT: CnH2n+2
\(n_{C_nH_{2n+2}}=\dfrac{2,9}{14n+2}\left(mol\right)\)
Bảo toàn C: \(n.\dfrac{2,9}{14n+2}=\dfrac{20}{100}=0,2\)
=> n = 4
=> CTPT: C4H10
Phản ứng tách:
- Tách H2: \(C_4H_{10}\underrightarrow{t^o,xt}C_4H_8+H_2\)
- Cracking: \(C_4H_{10}\underrightarrow{t^o,xt}\left[{}\begin{matrix}CH_4+C_3H_6\\C_2H_4+C_2H_6\end{matrix}\right.\)

Giả sử trong 2,58 g hỗn hợp A có X mol C n H 2 n + 2 (n > 1) và y mol C m H 2 m (m > 3). Vì M A = 25,8 X 2 (g/mol) nên :
x + y = 0,05 (1)
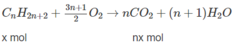
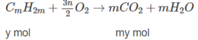
C O 2 + B a ( O H ) 2 → B a C O 3 ↓ + H 2 O
Số mol C O 2 = Số mol B a C O 3 = 0,18 (mol)
nx + my = 0,18 (2)
Khối lượng hỗn hợp A :
(14n + 2)x + 14my = 2,58 (3)
⇒ 14(nx + my) + 2x = 2,58 ⇒ 2x = 2,58 - 14 x 0,18
⇒ x = 0,03 ; y = 0,05 - 0,03 = 0,02
Thay giá trị của x và y vào (2) ta có
0,03n + 0,02m = 0,18
3n + 2m = 18
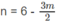
Nghiệm thích hợp là m = 3 ; n = 4.
Nghiệm m = 6 và n = 2 phải loại vì C 6 H 12 là chất lỏng (ts = 81 ° C ).
% về thể tích của
C
4
H
10
: 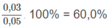
% về thể tích của C 3 H 6 : 100% - 60% = 40,0% thể tích hỗn hơp A.

nCO2=8,96/22,4=0,4 mol
=> nC=nCO2=0,4 mol
mC=0,4.12=4,8g
=> mH=5,8-4,8=1g
nH=1 mol -> nH2O=0,5
nH=0,5 mol
Pt: CnH2n+2 + (3n+1/2)O2-> nCO2 + (n+1)H2O
0,4 0,5 mol
=> n/0,4=n+1/0,5 -> n=4
Vậy cthh cần tìm là C4H10

Đáp án C
nCO2 = nBaCO3 = 35,46/197 = 0,18 mol; nA= 2,58/51,6 = 0,05 mol
mH = 2,58 – 0,18.12 = 0,42 gam
=> nH2O = 0,21 mol; nankan = 0,21 – 0,18 = 0,03 mol => nxicloankan = 0,02 mol;
CTPT của ankan và xicloankan lần lượt là: CnH2n+2 và CmH2m
ta có: 0,02n + 0,03m = 0,18 => 2n + 3m = 18 => n = 3 và m = 4.

a)
Gọi CT của ankan là CnH2n+2
CnH2n+2 + O2 \(\underrightarrow{t^o}\) nCO2 + (n+1)H2O
Theo đầu bài ta có: mCO2 + mH2O = 20,4
n = 3
Vậy CTPT của X là C3H8. …
Vì hỗn hợp Z tác dụng với dung dịch AgNO3/NH3 thu được kết tủa \(\rightarrow\) hiđrocacbon B có liên kết 3 đầu mạch.
Gọi CTTB của 2 hidrocacbon A và B là \(C_{\overline{x}}H_{\overline{y}}\)
\(C_{\overline{x}}H_{\overline{y}}\) + O2 \(\rightarrow\overline{x}\)CO2 + \(\frac{\overline{y}}{2}\)H2O
Theo đề bài ta có \(\overline{x}\) = 2,6 (vì \(\overline{x}\) = 2,6 nên hiđroccacbon B có số nguyên tử nhỏ hơn 2,6).
Vậy hiđrocacbon B là C2H2
Gọi \(n_{C_2H_2}=x,\) \(n_{C_3H_8}=y\) .Ta có: \(\begin{cases}x+y=0,1\\2x+3y=0,26\end{cases}\)\(\rightarrow\begin{cases}x=0,04\\y=0,06\end{cases}\)
Khối lượng kết tủa là C2Ag2 m = 9,6 gam

![]()
= 0,525 – 0,15 = 0,375 mol.
m↓ = 0,375.100 = 37,5 gam.
- Chọn đáp án A.

\(M_X=9,25.4=37\left(\dfrac{g}{mol}\right)=14m+2\\ \Leftrightarrow m=2,5\\ n_X=\dfrac{7,4}{37}=0,2\left(mol\right)\\ \Rightarrow n_{CO_2}=n_C=2,5.n_X=2,5.0,2=0,5\left(mol\right)\\ n_{BaCO_3}=n_{CO_2}=0,5\left(mol\right)\\ \Rightarrow m_{kt}=m_{BaCO_3}=197.0,5=98,5\left(g\right)\)
Sửa đề : 240 cm3
\(n_{CO_2}=\dfrac{1}{100}=0.01\left(mol\right)\)
\(n_{ankan}=\dfrac{0.0224}{22.4}=10^{-3}\left(mol\right)\)
\(SốC:\dfrac{0.01}{10^{-3}}=10\)
\(CTPT:C_{10}H_{22}\)
mơn bn nha!!!