Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Pt:
Fe3O4 + 4H2SO4 → FeSO4 + Fe2(SO4)3 + 4H2O
0,1 → 0,4 0,1 0,1
Cu + Fe2(SO4)3 → CuSO4 + 2FeSO4
0,1 ←0,1 → 0,1 0,2
Rắn B là 0,1 mol Cu → x = 6,4 (g)

Đặt \(\left\{{}\begin{matrix}n_{Fe}=x\left(mol\right)\\n_{Na_2SO_3}=y\left(mol\right)\end{matrix}\right.\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
x ---> x ----------> x -------> x
\(Na_2SO_3+H_2SO_4\rightarrow Na_2SO_4+H_2O+SO_2\)
y -----------> y -----------> y ------------------> y
Có: \(d_Y=13,4.2=26,8\left(\dfrac{g}{mol}\right)\)
\(\Rightarrow\dfrac{m_Y}{n_Y}=26,8\left(\dfrac{g}{mol}\right)\\ \Leftrightarrow\dfrac{2x+64y}{x+y}=26,8\)
\(\Rightarrow\dfrac{x}{y}=1,5\Leftrightarrow x-1,5y=0\left(1\right)\)
Mặt khác có: \(n_Y=x+y=0,02\left(2\right)\)
Từ (1), (2) giải được: \(\left\{{}\begin{matrix}x=0,012\\y=0,008\end{matrix}\right.\)
\(m=m_{Fe}+m_{Na_2SO_3}=56x+126y=56.0,012+126.0,008=1,68\left(g\right)\)
\(m_{dd.H_2SO_4}=\dfrac{\left(0,012+0,008\right).98.100\%}{20\%}=9,8\left(g\right)\)
\(m_{dd}=1,68+9,8-2.0,012-64.0,008=10,944\left(g\right)\)
\(C\%_{FeSO_4}=\dfrac{152.0,012.100\%}{10,944}=16,67\%\)
\(C\%_{Na_2SO_4}=\dfrac{142.0,008.100\%}{10,944}=10,38\%\)

a) Nhận xét: 33,84g X > 16g rắn → kim loại còn dư.
Chú ý: sau một thời gian ám chỉ các chất tham gia đều dư.
Giả sử số mol của Mg, Fe lần lượt là x, y
Tăng giảm khối lượng: (64 – 24) . x + (64 – 56) . y = 38,24 – 33,84 (1)
Chất rắn bao gồm MgO: x; Fe2O3: 0,5y; CuO: a – x – y
=> 40x + 160 . 0,5y + 80(a – x – y) = 16 (2)
Từ (1) và (2) => 10a + y = 2,55
amax <=> y = 0 => amax = 0,255
b) giá trị a đạt max thì Fe chưa tham gia pứ.
Giả sử số mol Mg dư là: z (mol) 19,12g Z cho 0,48 mol SO2 → 38,24g Z cho 0,96 mol SO2


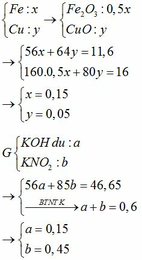
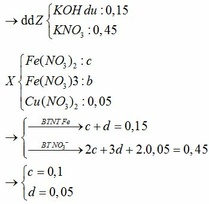

BTKL
mX + mdd HNO3 = mdd X + mH2O + m↑
=> mdd X = 11,6 + 87,5 – 30 . 0,1 – 46 . 0,15 = 89,2g
=> C%Fe(NO3)3 = 13,565%