Đốt cháy 12,4g Photpho trong bình chứa oxi tạo thành sản phẩm điphotpho pentaoxit. a) Tính khối lượng hợp chất tạo thành. b) Nếu trong bình chứa 17g khí oxi. Hỏi sau khi phản ứng kết thúc chất nào dư và dư bao nhiêu gam?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


nP = 2,48/31 = 0,08 (mol)
PTHH: 4P + 5O2 -> (t°) 2P2O5
Mol: 0,08 ---> 0,1 ---> 0,04
mP2O5 = 0,04 . 142 = 5,68 (g)
b) nO2 = 4/32 = 0,125 (mol)
So sánh: 0,125 > 0,1 => O2 dư
nO2 (dư) = 0,125 - 0,1 = 0,025 (mol)
mO2 (dư) = 0,025 . 32 = 0,8 (g)

a)
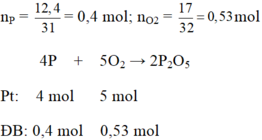
Xét tỉ lệ số mol đề bài với số mol phương trình của P và O2 ta có:

b) Chất tạo thành: đi photpho pentaoxit P2O5
Theo phương trình 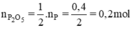
mP2O5 = n.M = 0,2.(31.2 + 16.5) = 28,4 (g)

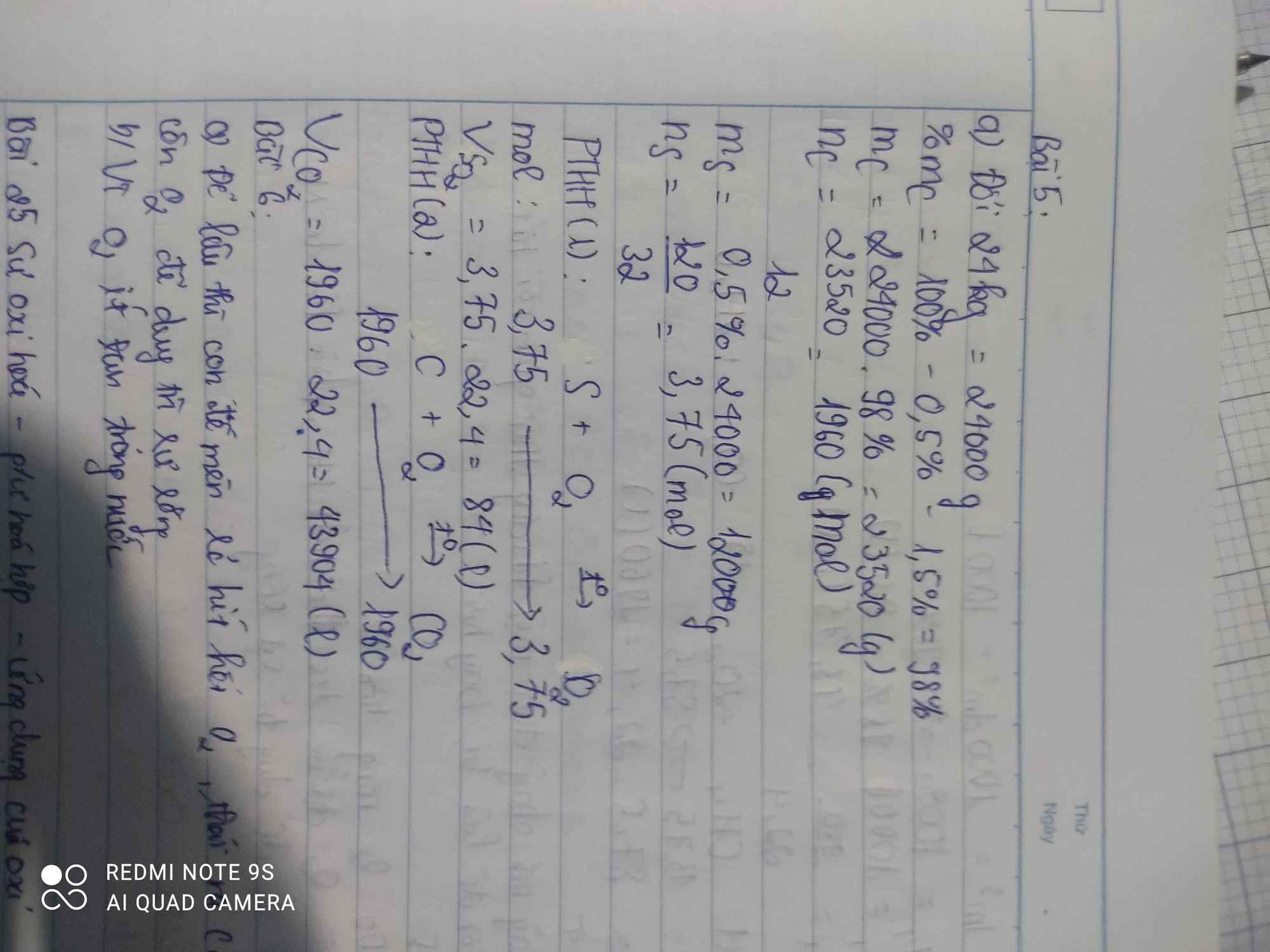
Bài 4:
a) \(n_P=\dfrac{12,4}{31}=0,4\left(mol\right)\)
\(n_{O_2}=\dfrac{17}{32}=0,53125\left(mol\right)\)
PTHH: 4P + 5O2 --to--> 2P2O5
Xét tỉ lệ: \(\dfrac{0,4}{4}< \dfrac{0,53125}{5}\) => P hết, O2 dư
PTHH: 4P + 5O2 --to--> 2P2O5
0,4-->0,5--------->0,2
=> \(n_{O_2\left(dư\right)}=0,53125-0,5=0,03125\left(mol\right)\)
b) \(m_{P_2O_5}=0,2.142=28,4\left(g\right)\)

a) $n_P = \dfrac{12,4}{31} = 0,4(mol) ; n_{O_2} = \dfrac{17}{32} = 0,53125(mol)$
$4P + 5O_2 \xrightarrow{t^o} 2P_2O_5$
Ta thấy :
$n_P : 4 < n_{O_2} : 5$ nên $O_2$ dư
$n_{O_2\ pư} = \dfrac{5}{4}n_P = 0,5(mol)$
$\Rightarrow n_{O_2\ dư} = 0,53125 - 0,5 = 0,03125(mol)$
b) Điphotpho pentaoxit được tạo thành
$n_{P_2O_5} = \dfrac{1}{2}n_P = 0,2(mol)$
$m_{P_2O_5} = 0,2.142 = 28,4(gam)$

Câu 1 :
\(n_P=\dfrac{12,4}{31}=0,4\left(mol\right)\)
Pt : \(4P+5O_2\underrightarrow{t^o}2P_2O_5|\)
4 5 2
0,4 0,2
\(n_{P2O5}=\dfrac{0,4.2}{4}=0,2\left(mol\right)\)
⇒ \(m_{P2O5}=0,2.142=28,4\left(g\right)\)
Chúc bạn học tốt
Câu 2 :
\(n_P=\dfrac{12,4}{31}=0,4\left(mol\right)\)
\(n_{O2\left(dktc\right)}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
Pt : \(4P+5O_2\underrightarrow{t^o}2P_2O_5|\)
4 5 2
0,4 0,25 0,1
Lập tỉ số só sánh : \(\dfrac{0,4}{4}>\dfrac{0,25}{5}\)
⇒ P dư , O2 phản ứng hết
⇒ Tính toán dựa vào số mol của O2
\(n_{P2O5}=\dfrac{0,25.2}{5}=0,1\left(mol\right)\)
⇒ \(m_{P2O5}=0,1.142=14,2\left(g\right)\)
\(n_{P\left(dư\right)}=0,4-\left(\dfrac{0,25.4}{5}\right)=0,2\left(mol\right)\)
⇒ \(m_{P\left(dư\right)}=0,2.31=6,2\left(g\right)\)
\(m_{rắn}=14,2+6,2=20,4\left(g\right)\)
Chúc bạn học tốt

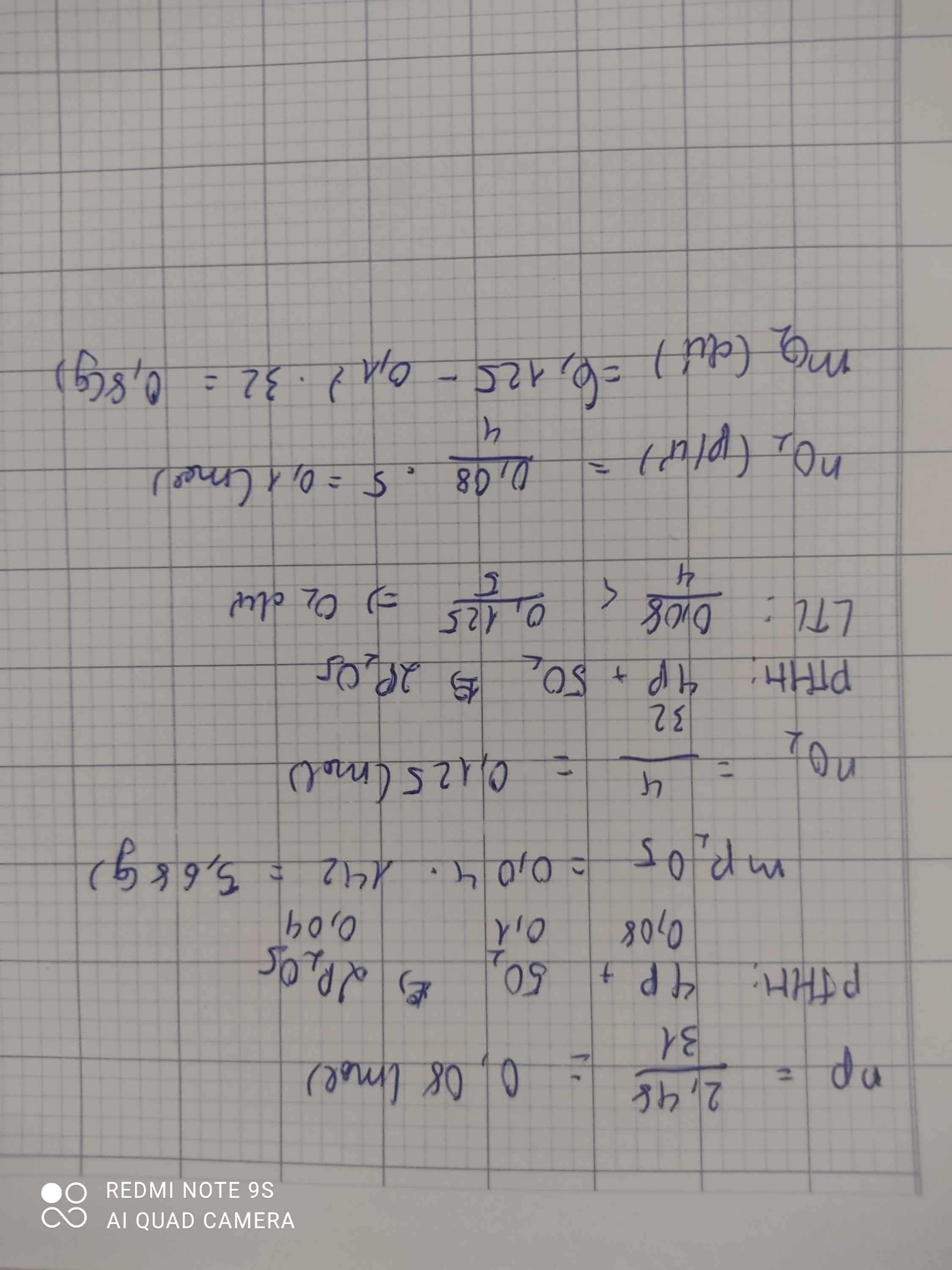

\(n_P=\dfrac{12,4}{31}=0,4\left(mol\right)\\ pthh:4P+5O_2\underrightarrow{t^o}2P_2O_5\)
0,4 0,2
\(m_{P_2O_5}=142.0,2=28,4g\)
\(n_{O_2}=\dfrac{17}{32}=0,53\left(mol\right)\)
\(pthh:4P+5O_2\underrightarrow{t^o}2P_2O_5\\ LTL:\dfrac{0,4}{4}< \dfrac{0,53}{5}\)
=> O2 dư
\(n_{O_2\left(p\text{ư}\right)}=\dfrac{5}{4}n_P=0,5\left(mol\right)\\ m_{O_2\left(d\right)}=\left(0,53-0,5\right).32=0,96g\)
`4P + 5O_2` $\xrightarrow[]{t^o}$ `2P_2 O_5`
`0,4` `0,5` `0,2` `(mol)`
`n_P = [ 12,4 ] / 31 = 0,4 (mol)`
`a) m_[P_2 O_5] = 0,2 . 142 = 28,4 (g)`
`b) n_[O_2] = 17 / 32 = 0,53125 (mol)`
Ta có: `[ 0,4 ] / 4 < [ 0,53125 ] / 5`
`->O_2` dư
`=> m_[O_2 (dư)] = ( 0,53125 - 0,5 ) . 32 = 1(g)`