Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bài 2:
\(n_P=\dfrac{12,4}{31}=0,4\left(mol\right)\)
PTHH: 4P + 5O2 → 2P2O5
Mol: 0,4 0,2
\(m_{P_2O_5}=0,2.142=28,4\left(g\right)\)
Bài 1:
\(n_{Al}=\dfrac{10,8}{27}=0,4\left(mol\right)\)
PTHH: 4Al + 3O2 ---to→ 2Al2O3
Mol: 0,4 0,3
\(V_{O_2}=0,3.22,4=6,72\left(l\right)\)

\(n_P=\dfrac{m}{M}=\dfrac{6,2}{31}=0,2\left(mol\right)\)
\(n_{O_2}=\dfrac{V}{22,4}=\dfrac{7,84}{22,4}=0,35\left(mol\right)\)
PTHH:\(4P+5O_2\rightarrow2P_2O_5\)
tpứ: 0,2 0,35
pứ: 0,2 0,25 0,1
spứ: 0 0,1 0,1
a)chất còn dư là oxi
\(m_{O_2dư}=n.M\)=0,1.32=3,2(g)
b)\(m_{P_2O_5}=n.M\)=0,1.142=14,2(g)

\(n_{P_2O_5}=\dfrac{28,4}{142}=0,2\left(mol\right)\)
\(n_{SO_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
PTHH: 4P + 5O2 --to--> 2P2O5
0,4<--------------0,2
S + O2 --to--> SO2
0,25<----------0,25
=> \(\left\{{}\begin{matrix}\%m_P=\dfrac{0,4.31}{0,4.31+0,25.32}.100\%=60,78\%\\\%m_S=\dfrac{0,25.32}{0,4.31+0,25.32}.100\%=39,22\%\end{matrix}\right.\)

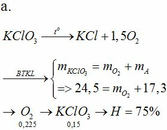
b.
4P + 5O2 → 2P2O5
0,16→ 0,2
Dư: 0,025
Sau pứ m(bình 1) = mP2O5 = 11,36 (g)
O2 + 2C → 2CO
0,025→ 0,05 0,05
Dư: 0,25
Sau pứ m(bình 2) = mCdư = 3 (g)

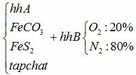
a) Gọi số mol của FeCO3: x (mol) ;
số mol của FeS2: y (mol)
4FeCO3 + O2 → Fe2O3 + 4CO2↑
x → 0,25x → x (mol)
4FeS2 +11O2 → 2Fe2O3 + 8SO2↑
y → 2,75y → 2y (mol)
∑ nO2 = 0,25x + 2,75y (mol)
Cùng điều kiện về nhiệt độ và áp suất nên tỉ lệ về thể tích = tỉ lệ về số mol
=> nN2 = 4nO2 = 4(0,25x + 2,75y)
=> nN2 = x + 11y (mol)
Vậy hỗn hợp Y gồm:
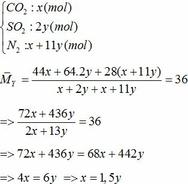
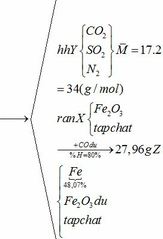
Khối lượng Fe có trong Z là:
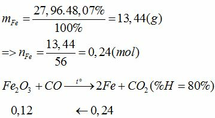
Vì H = 80% => nFe2O3 (trong X) = 0,12. 100% : 80% = 0,15 (mol)
nFe2O3 dư (trong Z) = 0,15 – 0,12 = 0,03 (mol)
Khối lượng tạp chất trong Z = 27,96 – mFe – mFe2O3 dư = 27,96 – 0,24.56 – 0,03.160 = 9,72 (g)
Bảo toàn nguyên tố Fe => nFeCO3 + nFeS2 = 2nFe2O3(trong X)
=> x + y = 0,3 (2)
Từ (1) và (2) => x = 0,18 và y = 0,12 (mol)
Áp dụng công thức PV = nRT ( với n = nCO2 + nSO2 + nN2 = 0,18 + 2. 0,12 + 0,18 +11.0,12 = 1,92)
=> P.10 = 1,92.0,082. (136,5 +273)
=> P = 6,447 ( atm) ≈ 6,5 (atm)
Ta có: mA = mFeCO3 + mFeS2 + mtạp chất = 0,18.116 + 0,12.120 + 9,72 = 45 (g)
![]()
b) hỗn hợp Y gồm:
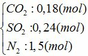
Cho hỗn hợp Y qua O2 ( xúc tác V2O5 ) có phản ứng sau:
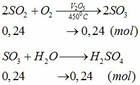
Khối lượng dd sau: mdd sau = mSO3 + mH2O = 0,24. 80 + 592,8 = 612 (g)
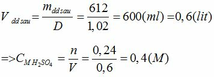

Đặt \(\left\{{}\begin{matrix}n_{Mg}=x\left(mol\right)\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\)
Theo đề: \(m_{hh}=36\left(g\right)\)
\(\Rightarrow m_{Mg}+m_{Fe}=36\\ \Rightarrow24x+56y=36\left(1\right)\)
\(PTHH:2Mg+O_2\underrightarrow{t^o}2MgO\\ \left(mol\right)....x\rightarrow...0,5x.....x\\ PTHH:3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\\ \left(mol\right)....y\rightarrow...\dfrac{2}{3}y....\dfrac{1}{3}y\)
Theo đề: \(n_{O_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
\(\Rightarrow0,5x+\dfrac{2}{3}y=0,6\left(2\right)\)
\(\xrightarrow[\left(2\right)]{\left(1\right)}\left\{{}\begin{matrix}24x+56y=36\\0,5x+\dfrac{2}{3}y=0,6\end{matrix}\right.\\ \Leftrightarrow\left\{{}\begin{matrix}x=0,8\\y=0,3\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}m_{Mg}=0,8.24=19,2\left(g\right)\\m_{Fe}=0,3.56=16,8\left(g\right)\end{matrix}\right.\\ m_r=m_{MgO}+m_{Fe_3O_4}=0,8.40+\dfrac{1}{3}.0,3.232=55,2\left(g\right)\)
PTHH: C+O2→CO20,3mol:0,3mol→0,3molC+O2→CO20,3mol:0,3mol→0,3mol
S+O2→SO20,2mol:0,2mol→0,2molS+O2→SO20,2mol:0,2mol→0,2mol
mC=36%10100%=3,6(g)⇔nC=3,612=0,3(mol)mC=36%10100%=3,6(g)⇔nC=3,612=0,3(mol)
mS=10−3,6=6,4(g)⇔nS=6,432=0,2(mol)mS=10−3,6=6,4(g)⇔nS=6,432=0,2(mol)
VO2=(0,3+0,2)22,4=11,2(l)VO2=(0,3+0,2)22,4=11,2(l)
mhh=mCO2+mSO2=0,3.44+0,2.64=26(g)

Đặt \(\left\{{}\begin{matrix}n_{Al}=x\left(mol\right)\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\)
Theo đề: \(m_{hh}=39\left(g\right)\)
\(\Rightarrow m_{Al}+m_{Fe}=39\\ \Rightarrow27x+56y=39\left(1\right)\)
\(PTHH:4Al+3O_2\underrightarrow{t^o}2Al_2O_3\\ \left(mol\right)....x\rightarrow..0.75x....0,5x\\ PTHH:3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\\ \left(mol\right)....y\rightarrow..\dfrac{2}{3}y.....\dfrac{1}{3}y\)
Theo đề: \(n_{O_2}=\dfrac{V}{22,4}=\dfrac{12,32}{22,4}=0,55\left(mol\right)\)
\(\Rightarrow0,75x+\dfrac{2}{3}y=0,55\left(2\right)\)
\(\xrightarrow[\left(1\right)]{\left(2\right)}\left\{{}\begin{matrix}27x+56y=39\\0,75x+\dfrac{2}{3}y=0,55\end{matrix}\right.\\ \Leftrightarrow\left\{{}\begin{matrix}x=0,2\\y=0,6\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}m_{Al}=0,2.27=5,4\left(g\right)\\m_{Fe}=0,6.56=33,6\left(g\right)\end{matrix}\right.\\ m_r=m_{Al_2O_3}+m_{Fe_3O_4}=0,5.0,2.102+\dfrac{1}{3}.0,6.232=56,6\left(g\right)\)

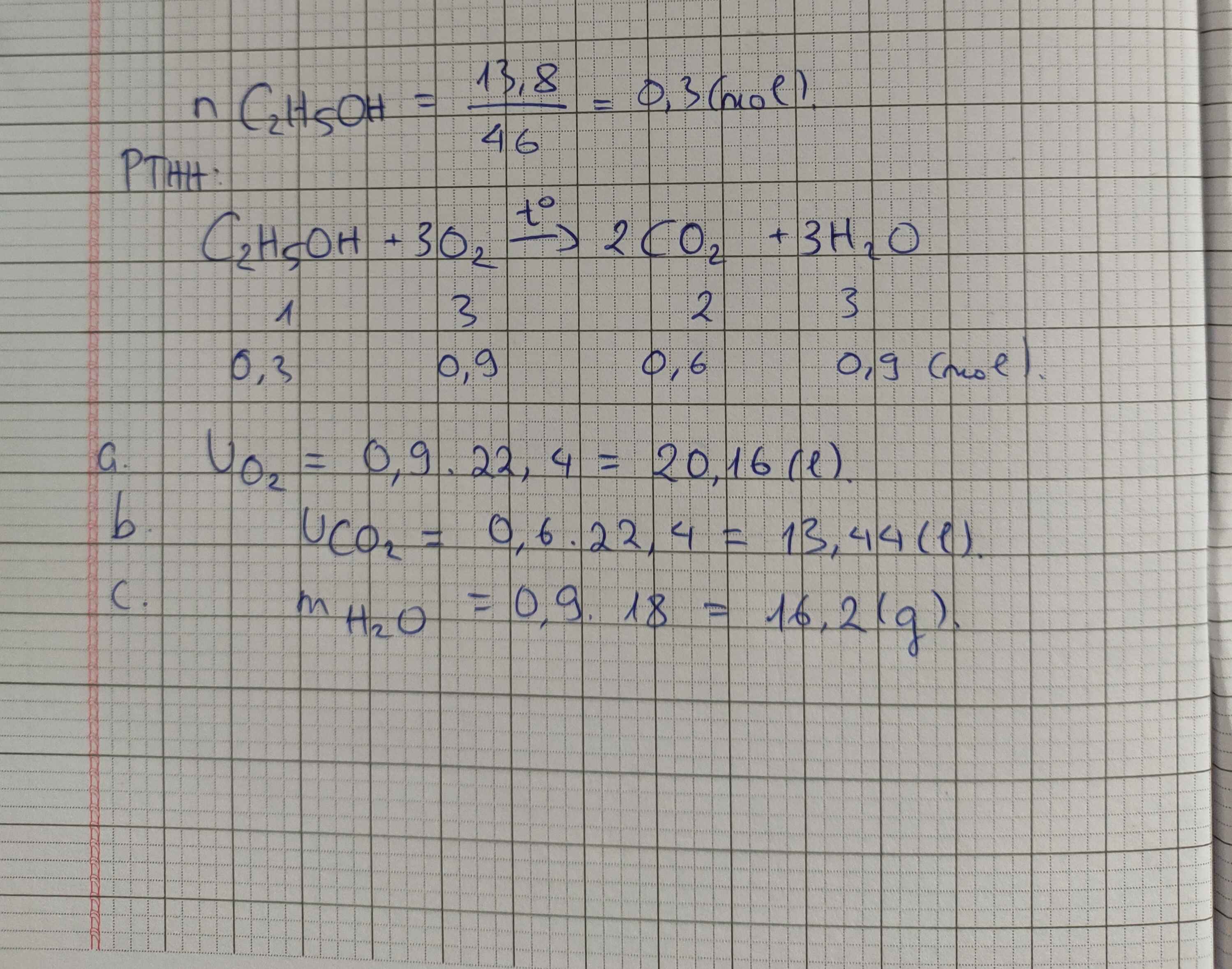
Câu 1 :
\(n_P=\dfrac{12,4}{31}=0,4\left(mol\right)\)
Pt : \(4P+5O_2\underrightarrow{t^o}2P_2O_5|\)
4 5 2
0,4 0,2
\(n_{P2O5}=\dfrac{0,4.2}{4}=0,2\left(mol\right)\)
⇒ \(m_{P2O5}=0,2.142=28,4\left(g\right)\)
Chúc bạn học tốt
Câu 2 :
\(n_P=\dfrac{12,4}{31}=0,4\left(mol\right)\)
\(n_{O2\left(dktc\right)}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
Pt : \(4P+5O_2\underrightarrow{t^o}2P_2O_5|\)
4 5 2
0,4 0,25 0,1
Lập tỉ số só sánh : \(\dfrac{0,4}{4}>\dfrac{0,25}{5}\)
⇒ P dư , O2 phản ứng hết
⇒ Tính toán dựa vào số mol của O2
\(n_{P2O5}=\dfrac{0,25.2}{5}=0,1\left(mol\right)\)
⇒ \(m_{P2O5}=0,1.142=14,2\left(g\right)\)
\(n_{P\left(dư\right)}=0,4-\left(\dfrac{0,25.4}{5}\right)=0,2\left(mol\right)\)
⇒ \(m_{P\left(dư\right)}=0,2.31=6,2\left(g\right)\)
\(m_{rắn}=14,2+6,2=20,4\left(g\right)\)
Chúc bạn học tốt