Nhúng 1 thanh kẽm vào dung dịch chưa 8,5g AgNO3 sau phản ứng lấy kẽm rửa sạch thấy khối lượng kẽm tăng 5%. Xác định khối lượng kẽm
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


PT: \(Zn+2AgNO_3\rightarrow Zn\left(NO_3\right)_2+2Ag\)
Ta có: \(n_{AgNO_3}=\dfrac{8,5}{170}=0,05\left(mol\right)\)
Theo PT: \(n_{Zn\left(pư\right)}=\dfrac{1}{2}n_{AgNO_3}=0,025\left(mol\right)\)
\(n_{Ag}=n_{AgNO_3}=0,05\left(mol\right)\)
Có: m tăng = mAg - mZn (pư) = 0,05.108 - 0,025.65 = 3,775 (g)
Mà: m tăng = 8%mZn ban đầu
⇒ m Zn ban đầu = 47,1875 (g)

nAgNo3=6.4/170=16/425mol
Zn+ 2AgNo3->Zn(No3)2
8/425 16/425
+2Ag
16/425
mKL.tăg=108*(16/425)-65*(8/425)=1208/425g
m.tăg=4%mZn
->mZn=1208/17g

\(n_{Zn\left(pứ\right)}=1,3-0,65=0,65g\)
\(n_{Zn}=\dfrac{0,65}{65}=0,01mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,01 0,02 0,01 0,01 ( mol )
\(V_{H_2}=0,01.24=0,24l\)
\(m_{HCl}=\dfrac{0,02.36,5}{7,3\%}=10g\)
\(m_{ZnCl_2}=0,01.136=1,36g\)
\(m_{ddspứ}=1,3+10-0,01.2=11,28g\)
\(C\%_{ZnCl_2}=\dfrac{1,36}{11,28}.100=12,05\%\)
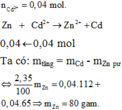

gọi m Zn bđ= m
nAgNO3 = 0,05 mol
Zn + 2AgNO3 => Zn(NO3)2 + 2Ag
0,025<--0,05----->0.025--------->0,05
mZn tăng = 0,025( 216-65) = 3,775
<=> 5%m = 3,775 => m = 75,5 (g)