Bài 1: Cho phương trình hóa học:
Fe + HCl -> FeCl2 + H2
a) Tính khối lượng sắt axit clohidric (HCl) biết thể tích khí thu được ở đktc là 3,36 lít.
b) Tính khối lượng sắt (II) clorua (FeCl2).
Bài 2: Một hợp chất khí có thành phần phần trăm theo khối lượng là 82,35 % N , 17,65 % H.
a) Viết CTHH dạng đúng của hợp chất biết hợp chất có tỉ khối so với khí hidro là 8,5.
b) Số mol nguyên tử mỗi nguyên tố có trong 0,5 mol hợp chất.

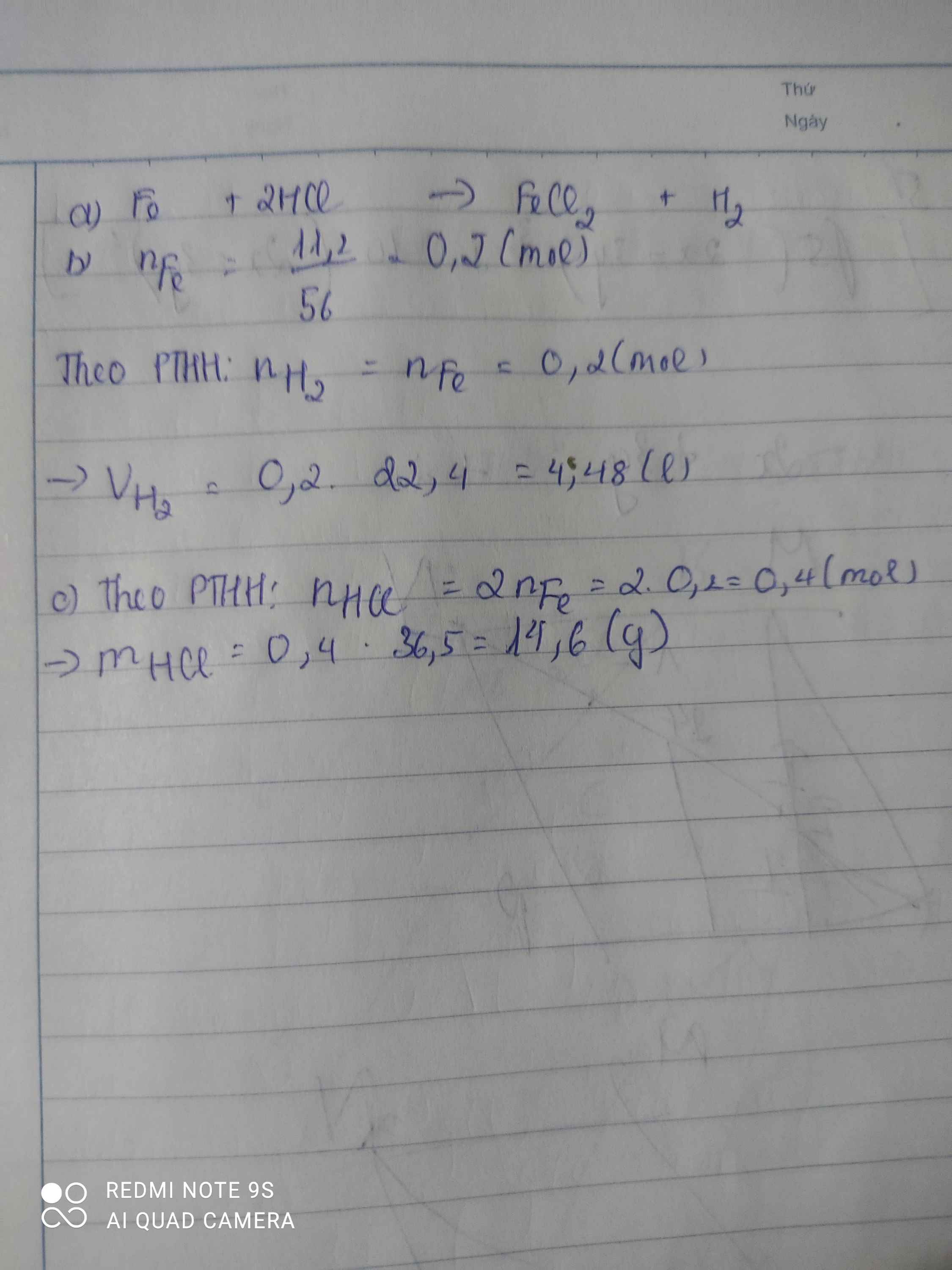
Bài 1: a)
nH = \(\frac{3,36}{22,4}\)= 0.15 mol
PTHH: Fe + 2HCL --> FeCl2 + H2
Pt: 1 --> 2 -------> 1 ------> 1 (mol)
PƯ: 0.15 <- 0,3 <-- 0, 15 <--- 0,15 (mol)
mHCL = n . M = 0,3 . (1 + 35,5) = 10,95 g
b) mFeCL2 = 0,15 . (56 + 2 . 35,5) = 19,05 g
mik nghĩ thế