Bài học cùng chủ đề
Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Quy tắc octet SVIP
I. KHÁI NIỆM LIÊN KẾT HOÁ HỌC
- Liên kết hóa học là sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn.
- Khi tạo liên kết hóa học nguyên tử có xu hướng đạt tới cấu hình electron bền vững của khí hiếm và chỉ có các electron hóa trị tham gia vào quá trình hình thành liên kết.
- Các electron hóa trị của nguyên tử một nguyên tố được quy ước biểu diễn bằng các dấu chấm đặt xung quanh kí hiệu nguyên tố.

II. QUY TẮC OCTET
Ví dụ 1: Sự hình thành liên kết phân tử Cl2
Nguyên tử Cl có 7 electron hóa trị. Mỗi nguyên tử chlorine cần 1 electron để đạt cấu hình electron bão hòa theo quy tắc octet do đó mỗi nguyên tử chlorine góp chung 1 electron.

Ví dụ 2: Sự hình thành liên kết phân tử NaF
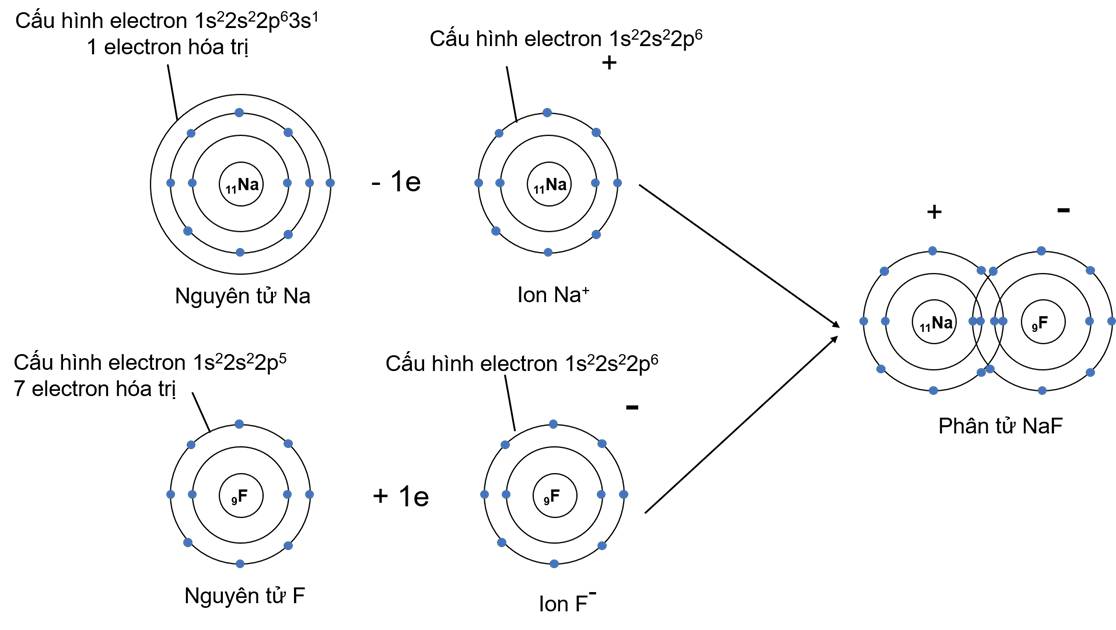
- Khi hình thành liên kết hóa học trong phân tử NaF, nguyên tử Na có 1 electron hóa trị, nguyên tử F có 7 electron hóa trị.Nguyên tử Na nhường 1 electron để trở thành hạt mang điện tích dương, nguyên từ F nhận 1 electron để trở thành hạt mang điện tích âm. Hai hạt này đều đạt cấu hình electron bão hòa theo quy tắc octet và có điện tích trái dấu nên hút nhau hình thành nên phân tử NaF.
Lưu ý: Quy tắc octet chỉ đúng cho sự tạo thành liên kết hóa học của các nguyên tố thuộc chu kì 2 và một số kim loại, phi kim điển hình.
Ngoài ra còn các ngoại lệ như phân tử PCl5

@200153660969@@200153687682@
1. Liên kết hóa học là sự kết hợp giữa các nguyên tử tạo thành phân tử hay tinh thể bền vững hơn.
2. Quy tắc octet: Khi hình thanh liên kết hóa học, các nguyên tử có xu hướng nhường, nhận hoặc góp chung electron để đạt tới cấu hình electron bền vững của nguyên tử khí hiếm.

Bạn có thể đánh giá bài học này ở đây