Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Liên kết ion:
`-` Liên kết ion được hình thành bởi lực hút giữa `2` ion trái dấu `(` Kim loại `-` Phi kim`)`.
Liên kết cộng hóa trị:
`-` Liên kết cộng hóa trị được hình thành giữa `2` nguyên tử bằng một hay nhiều cặp electron dùng chung.

Các nguyên tử của nguyên tố có xu hướng kết hợp với nhau để có số electron ở lớp ngoài cùng giống nguyên tử của nguyên tố khí hiếm.

- Hydrogen gần với nguyên tố khí hiếm Helium
- H có 1 electron lớp ngoài cùng, He có 2 electron lớp ngoài cùng
=> Nguyên tử hydrogen có xu hướng nhận thêm 1 electron để đạt cấu hình của Helium
- Oxygen gần với nguyên tố khí hiếm Neon
- H có 6 electron lớp ngoài cùng, Ne có 8 electron lớp ngoài cùng
=> Nguyên tử Oxygen có xu hướng nhận thêm 2 electron để đạt cấu hình của Neon

Đều có 8e lơp ngoài cùng
Riêng heli thì chỉ có 2e lnc
ngoại trừ He, các nguyên tố khí hiếm còn lại đều có số e lớp ngoài cùng là 8

Nguyên tử Cl có 7 electron lớp ngoài cùng và cần thêm 1 electron để có lớp vỏ bền vững tương tự khí hiếm.
Từ đây em tự vẽ khi mỗi nguyên tử góp 1e dùng chung

- Xét phân tử hydrogen: mỗi nguyên tử hydrogen có 2 electron lớp ngoài cùng
=> Giống cấu hình electron của nguyên tử khí hiếm Helium
- Xét phân tử Oxygen: mỗi nguyên tử Oxygen có 8 electron ở lớp ngoài cùng
=> Giống cấu hình electron của nguyên tử khí hiếm Neon

- Nguyên tử N nằm ở ô số 7, nhóm VA => Có 5 electron ở lớp ngoài cùng, cần 3 electron để đạt cấu hình khí hiếm
- Nguyên tử C nằm ở ô số 6, nhóm IVA => Có 4 electron ở lớp ngoài cùng, cần 4 electron để đạt cấu hình khí hiếm
- Nguyên tử O nằm ở ô số 8, nhóm VIA => Có 6 electron ở lớp ngoài cùng, cần 2 electron để đạt cấu hình khí hiếm
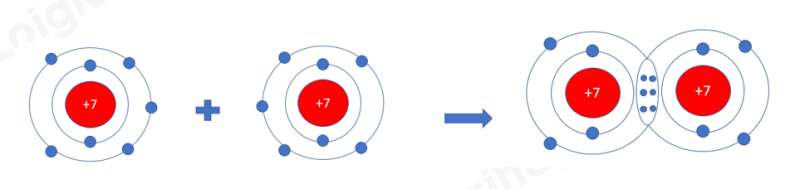
a) Xét phân tử Nitrogen: gồm 2 nguyên tử N
=> Liên kết cộng hóa trị, mỗi N góp 3 electron tạo thành 3 cặp electron dùng chung
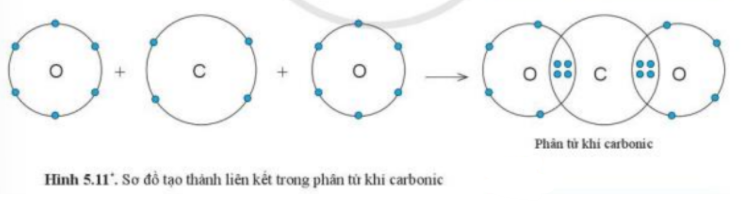
b) Xét phân tử Carbon dioxide: gồm 1 nguyên tử C và 2 nguyên tử O
=> Liên kết cộng hóa trị. Khi C kết hợp với O, nguyên tử C góp 4 electron, mỗi nguyên tử O góp 2 electron
=> Giữa nguyên tử C và nguyên tử O có 2 cặp electron dùng chung

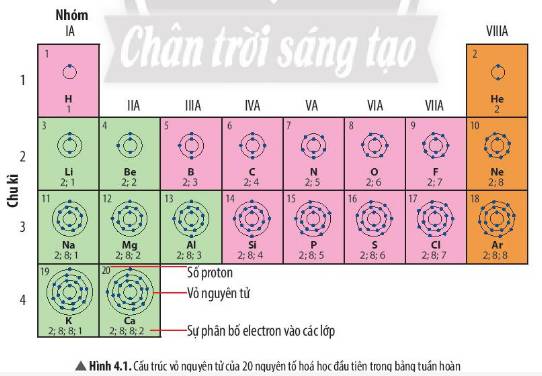
- Xét nguyên tố có số thứ tự 9:
+ Nằm ở nhóm VIIA => Có 7 electron ở lớp vỏ ngoài cùng và thuộc phi kim hoạt động mạnh
- Xét nguyên tố có số thứ tự 18:
+ Nằm ở nhóm VIIIA => Có 8 electron ở lớp vỏ ngoài cùng và là khí hiếm
- Xét nguyên tố có số thứ tự 19:
+ Nằm ở nhóm IA => Có 1 electron ở lớp vỏ ngoài cùng thuộc kim loại hoạt động mạnh

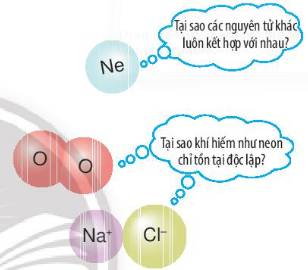
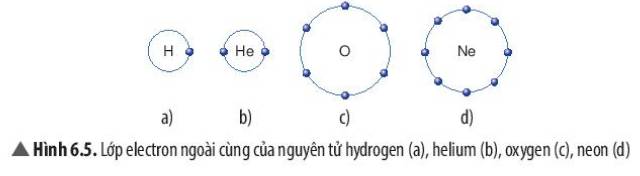


Lớp vỏ ngoài cùng của các nguyên tử khí hiếm có 8 electron (riêng He có 2 electron) là lớp vỏ bền vững. Vì vậy, các nguyên tử khí hiếm tồn tại độc lập trong điều kiện thường.