Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

n C 6 H 12 O 6 = 50/180 ≈ 0,278 mol
Cứ 0,278 mol glucozơ khi oxi hóa hoàn toàn thì tỏa ra 146,3kJ
Vậy 1 mol → x? kJ
x = 146,3/0278 = 526,3kJ

Nhiệt lượng toả ra khi đốt cháy hoàn toàn 1 kg etilen là :
1423/28 x 1000g = 50821,4kJ
Nhiệt lượng toả ra khi đốt cháy hoàn toàn 1 kg axetilen là :
1320/26 x 10006 = 50769,2kJ

Số mol của axetilen là :
11,2/22,4 x 20/100 = 0,1 mol
Số mol của etilen là :
11,2/22,4 x 80/100 = 0,4 mol
Vậy nhiệt lượng toả ra khi đốt là
(0,1 x 1320) + (0,4 x 1423) = 701,2 (kJ).

\(n_{CO_2}=\dfrac{3.52}{44}=0.08\left(mol\right)\)
\(n_{H_2O}=\dfrac{1.8}{18}=0.1\left(mol\right)\)
\(m_N=1.72-0.08\cdot12-0.1\cdot2=0.56\left(g\right)\)
\(n_N=\dfrac{0.56}{14}=0.04\left(mol\right)\)
\(M_E=\dfrac{1.29}{\dfrac{0.96}{32}}=43\left(đvc\right)\)
\(n_E=\dfrac{1.72}{43}=0.04\left(mol\right)\)
Số nguyên tử C : \(\dfrac{0.08}{0.04}=2\)
Số nguyên tử H : \(\dfrac{0.2}{0.04}=5\)
Số nguyên tử N : \(\dfrac{0.04}{0.04}=1\)
\(CT:C_2H_5N\)

1/
\(MA=15.2=\dfrac{30g}{mol}\)
\(nC=\dfrac{\dfrac{80.30}{100}}{12}=2\left(mol\right)\)
\(nH=\dfrac{\dfrac{20.30}{100}}{1}=6\left(mol\right)\)
Vậy CTPT của A là \(C_2H_6\)
2/
pthh:
\(2C_2H_6+7O_2\underrightarrow{t^o}4CO_2\uparrow+6H_2O\)
2mol 7mol 4mol 6mol
\(nO_2=\dfrac{6}{32}=0,1875\left(mol\right)\)
\(\Rightarrow nCO_2=\dfrac{4}{7}.nO_2=\dfrac{4}{7}.0,1875=0,11\left(mol\right)\)
\(mCO_2=0,11.\left(12+16.2\right)=4,7\left(g\right)\)
\(nH_2O=\dfrac{6}{7}.nO_2=\dfrac{6}{7}.0,1825=0,156\left(mol\right)\)
\(mH_2O=0,156.18=2,82\left(g\right)\)
ui sr cái cuối kêu đi tính V ko khí , bổ sung lại :
\(VO_2=0,1875.22,4=4,2\left(l\right)\)
\(\Rightarrow V_{kk}=5.VO_2=5.4,2=21\left(l\right)\)
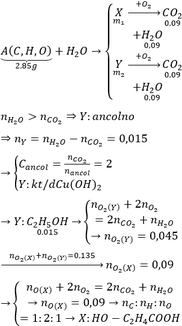
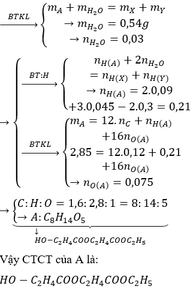

Cứ 1g chất béo khi bị oxi hóa hoàn toàn tỏa ra 38kJ
Vậy 15g chất béo khi bị oxi hóa hoàn toàn tỏa ra x kJ
x = 15.38/1 = 570kJ