Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Suy luận:
3Cu+ 8H++ 2NO3- → 3Cu2++ 2NO + 4 H2O
TN1: 4V1 ← V1 lít
TN2: 8V1 ← 2V1 lít
Nhận thấy: nH+ (TN2)= 2nH+ (TN1) → (1) là KNO3; (2) là HNO3; (3) là H2SO4
3Cu+ 8H++ 2NO3- → 3Cu2++ 2NO + 4 H2O
TN1: ban đầu 5.10-3 10.10-3
Phản ứng 5.10-3 1,25.10-3
TN3: ban đầu 15.10-3 5.10-3
Phản ứng 15.10-3 3,75.10-3
Các thể tích khí đo ở cùng điều kiện nên nNO(TN3)= 3nNO (TN1) → VNO(TN3)= 3VNO (TN1) hay V2= 3 V1
Đáp án B

nCu = 0,1
TN1: nH+ = 0,12
3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O (1)
0,045 ← 0,12 → 0,03 (mol) ⇒ Cu dư
TN2: nH+ = 0,24
3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O (2)
0,09 ←0,24 → 0,06 ⇒ Cu dư
Vậy nNO/(2) = 2nNO/(1) ⇒ 2a =b
Đáp án B.

n K2CO3 = V2(mol) ; n HCl = V1(mol)
K2CO3 + HCl → KCl + KHCO3(1)
KHCO3 + HCl → KCl + CO2 + H2O
0,1............0,1................0,1........................(mol)
Suy ra:
KHCO3 + HCl → KCl + CO2 + H2O
0,15..........0,15................0,15.................(mol)
Suy ra :
n KHCO3 (1) = 0,15 + 0,1 = 0,25(mol)
=> V2 = 0,25
=> V1 = n HCl = 0,25 + 0,1 = 0,35

\(n_{Cu}=\dfrac{9,6}{64}=0,15\left(mol\right)\)
\(n_{HNO_3}=0,18\left(mol\right)\)
\(+TH_1:\)
Vì thu được \(NO\) duy nhất → Có 2 trường hợp xảy ra, hoặc là `Cu` hết hoặc là `HNO_3` hết
\(\left[e\right]:2.0,15=3.n_{NO}\Leftrightarrow n_{NO}=0,1\left(mol\right)\)
Mặt khác ta có: \(n_{H^+}=4n_{NO}=0,18\Leftrightarrow n_{NO}=0,045\left(mol\right)\)
→ Chứng tỏ `Cu` dư
\(NO\left(0,045\right)\underrightarrow{+O_2}NO_2\rightarrow HNO_3\)
\(PTHH:NO_2+\dfrac{1}{2}O_2+H_2O\rightarrow2HNO_3\)
\(\left(mol\right)\) \(0,045\) \(0,0225\)
→ Tính theo oxi
\(\Rightarrow n_{HNO_3}=0,0225.2.2=0,09\left(mol\right)\\
\Rightarrow\left[H^+\right]=\dfrac{0,09}{0,2}=0,45\left(M\right)\\
\Rightarrow pH=-log\left(H^+\right)\approx0,35\)
\(+TH_2:\) Tóm tắt các phản ứng như sau
\(0,15\left(mol\right)Cu+\left\{{}\begin{matrix}H_2SO_4:0,09\left(mol\right)\\HNO_3:0,18\left(mol\right)\end{matrix}\right.\rightarrow V\left(l\right)NO+B\left\{{}\begin{matrix}Cu\left(NO_3\right)_2:0,135\\SO_4^{2-}:0,09\end{matrix}\right.+Cu:0,015\left(mol\right)\)
Tương tự như trường hợp 1 ta có:
\(n_{H^+}=4n_{NO}\Leftrightarrow0,36=4n_{NO}\Leftrightarrow n_{NO}=0,09\left(mol\right)\) và \(Cu\) dư \(0,015\left(mol\right)\)
\(\left\{{}\begin{matrix}0,045\left(mol\right)Cu\left(NO_3\right)_2\\0,09\left(mol\right)CuSO_4\end{matrix}\right.+Cu\left(0,015\right)\underrightarrow{t^o}\left\{{}\begin{matrix}CuO:0,045\\CuSO_4:0,09\\Cu:0,015\end{matrix}\right.\)
\(\rightarrow m=0,45.80+0,09.160+0,015.64=18,96\left(g\right)\)

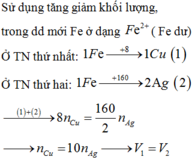

Đây chỉ là một bài toán về kim loại Cu tác dụng với dung dịch có chứa NO3- và H+ đơn giản.
Để giải quyết bài này ta chỉ cần sử dụng đến phương trình ion thu gọn để giải quyết.
Thí nghiệm 1: ta có:
Xét phản ứng: 3Cu + 2NO3- + 8H+ → 3 C u 2 + +2NO + 4 H 2 O
Ban đầu: 0,12 (mol) 0,16 0,16
Phản ứng: 0,06 0,04 0,16 0,04
Sau phản ứng: 0,06 0,12 0 0,04
Thí nghiệm 2: ta có:
Xét phản ứng: 3Cu + 2 N O - 3 + 8 H + → 3 C u 2 + + 2NO + 4 H 2 O
Ban đầu: 0,12 (mol) 0,16 0,32
Phản ứng: 0,12 0,08 0,32 0,08
Sau phản ứng: 0 0,08 0 0,08
Ta thấy:
Đáp án C.