Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

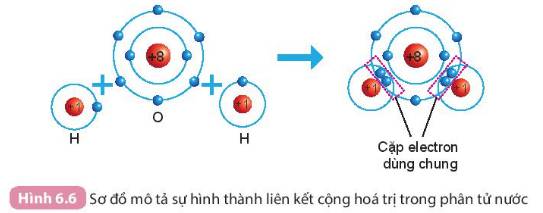
- Số electron dùng chung của nguyên tử H và O là 4
- Trong phân tử nước:
+ Nguyên tử O có 8 electron lớp ngoài cùng => Giống khí hiếm Ne
+ Nguyên tử H có 2 electron lớp ngoài cùng => Giống khí hiếm He

- Xét phân tử hydrogen: mỗi nguyên tử hydrogen có 2 electron lớp ngoài cùng
=> Giống cấu hình electron của nguyên tử khí hiếm Helium
- Xét phân tử Oxygen: mỗi nguyên tử Oxygen có 8 electron ở lớp ngoài cùng
=> Giống cấu hình electron của nguyên tử khí hiếm Neon

Lớp vỏ của ion Na+ có 10 electron tương tự lớp vỏ nguyên tử của nguyên tố khí hiếm neon.
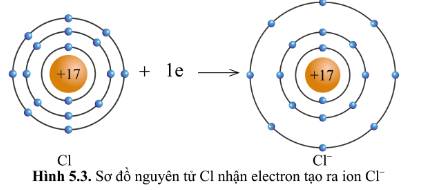
Lớp vỏ của ion Cl- có 18 electron tương tự lớp vỏ nguyên tử của nguyên tố khí hiếm argon.

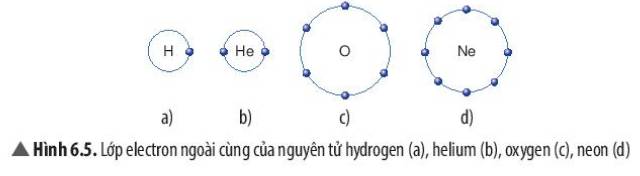
a)He -> số e ngoài cùng: 2
b)Ne -> số e ngoài cùng: 8
c) Ar-> số e ngoài cùng: 8

- Các electron sắp xếp thành từng lớp theo thứ tự từ trong ra ngoài: Lớp thứ nhất (lớp trong cùng) → Lớp thứ 2 → Lớp thứ 3
2.
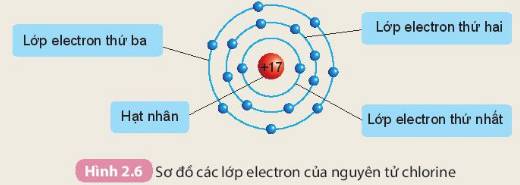
- Số electron trên từng lớp ở vỏ nguyên tử chlorine:
+ Lớp thứ nhất có 2 electron
+ Lớp thứ hai có 8 electron
+ Lớp thứ ba có 7 electron

1. Nguyên tử nguyên tố H , nguyên tử nguyên tố He có 1 lớp e
Nguyên tử nguyên tố Li, Be, C, N có 2 lớp e.
2. STT chu kì của nguyên tử nguyên tố H, He (1) < STT chu kì của nguyên tử nguyên tố Li, Be, C, N (2)

Nguyên tử Cl có 7 electron lớp ngoài cùng và cần thêm 1 electron để có lớp vỏ bền vững tương tự khí hiếm.
Từ đây em tự vẽ khi mỗi nguyên tử góp 1e dùng chung





Ne
Nguyên tử `O` liên kết với nguyên tử `H` theo cách dùng chung electron, vỏ nguyên tử lớp oxygen giống lớp vỏ của nguyên tử khí hiếm `Ne`.