Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Trong 2 mol phân tử C O N H 2 2 có:
Nguyên tố C: 2x1 = 2 mol nguyên tử C.
Nguyên tố O: 2x1 = 2 mol nguyên tử O.
Nguyên tố N: 2x2 = 4 mol nguyên tử N.
Nguyên tố H: 2x4 = 8 mol nguyên tử H.

Thành phần % các nguyên tố trong ure:
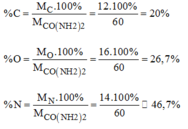
%H = 100-(%C + %O + %N) = 100- ( 20 + 26,7 + 46,7) = 6,6%

a) \(M_{\left(NH_2\right)_2CO}=\left(14.1+1.2\right).2+12.1+16.1=60\left(g/mol\right)\)
b) \(\left\{{}\begin{matrix}\%N=\dfrac{2.14}{60}.100\%=46,67\%\\\%H=\dfrac{1.4}{60}.100\%=6,67\%\\\%C=\dfrac{12.1}{60}.100\%=20\%\\\%O=100\%-46,67\%-6,67\%-20\%=26,66\%\end{matrix}\right.\)

\(\%N\left(CO\left(NH_2\right)_2\right)=\dfrac{2.14}{60}.100\%=46,67\%\)
\(\%N\left(\left(NH_4\right)_2SO_4\right)=\dfrac{2.14}{132}.100\%=21,21\%\)
\(\%N\left(NH_4NO_3\right)=\dfrac{2.14}{80}.100\%=35\%\)
\(\%N\left(Ca\left(NO_3\right)_2\right)=\dfrac{2.14}{164}.100\%=17,07\%\)
=> CO(NH2)2 có hàm lượng N cao nhất
=> A

Câu 2 :
a)
\(n_{CO_2} = \dfrac{0,3.10^{23}}{6.10^{23}} = 0,05(mol)\\ n_{O_2} = \dfrac{0,9.10^{23}}{6.10^{23}} = 0,15(mol)\)
Vậy :
\(\%n_{CO_2} = \dfrac{0,05}{0,15+0,05}.100\% = 25\%\\ \%n_{O_2} = 100\% - 25\% = 75\%\)
b)
Sục hỗn hợp vào dung dịch Ca(OH)2 lấy dư,thu lấy khí thoát ra ta được O2.Lọc dung dịch,thu lấy kết tủa
\(Ca(OH)_2 + CO_2 \to CaCO_3 + H_2O\)
Cho kết tủa vào dung dịch HCl lấy dư, thu lấy khí thoát ra. Ta thu được khí CO2
\(CaCO_3 + 2HCl \to CaCl_2 + CO_2 + H_2O\)
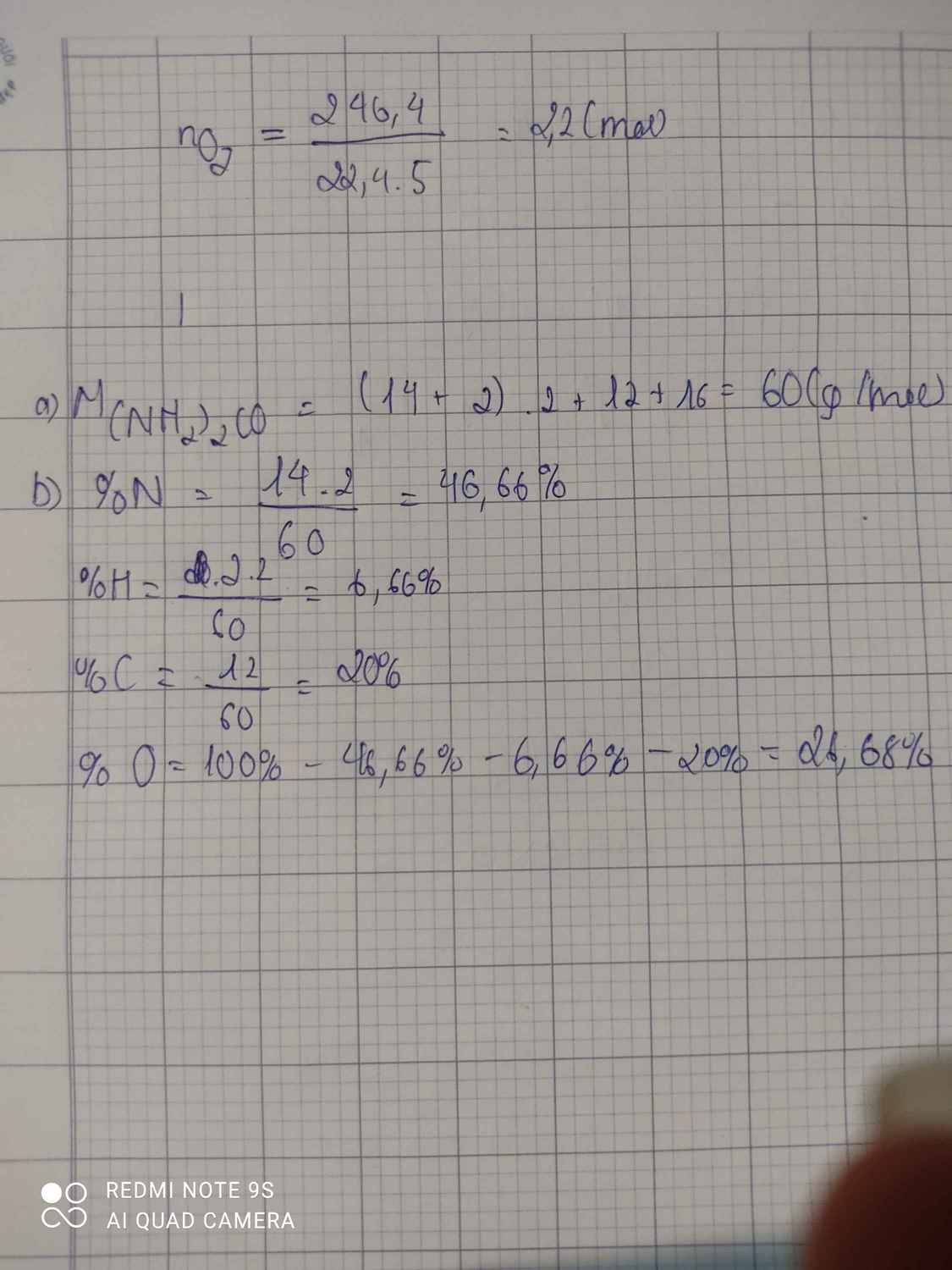

M C O N H 2 2 = 12+16+2.(14+2.1) = 60(g)