Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
- Hợp chất được cấu tạo từ các nguyên tố Ca, C và O
- Trong đó có 1 nguyên tử Ca, 1 nguyên tử C và 3 nguyên tử O
- PTK: 100 đvC
b)
\(\%P=\dfrac{31\cdot2}{142}\cdot100\%\approx43,66\%\)
c)
Gọi công thức cần tìm là SxOy
Ta có: \(\dfrac{32x}{32x+16y}=\dfrac{40}{100}\) \(\Rightarrow\dfrac{x}{y}=\dfrac{1}{3}\)
\(\Rightarrow\) CTHH cần tìm là SO3

Công thức hóa học: S x O y
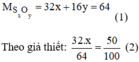
Giải phương trình (2) ta được: x = 1 thay vào pt (1) ⇒ y = 2.
Vậy công thức hóa học của oxit là S O 2

X có công thức hóa học dạng: SxOy
%mO = \(\dfrac{16y}{32x+16y}.100\%\) = 50%
=> 32x - 16y = 0 (1)
Tỉ khối của Oxit so với hidro là 32 => Moxit = 32.2 = 64 g/mol
=> 32x + 16y = 64 (2)
Từ (1) và (2) => x = 1 và y = 2
Vậy công thức hóa học của oxit cần tìm là SO2

1.\(\dfrac{m_{Al}}{m_O}=\dfrac{9}{8}\)
\(Al_xO_y\)
\(x:y=\dfrac{9}{27}:\dfrac{8}{16}=\dfrac{1}{3}:\dfrac{1}{2}=2:3\)
Vậy CTHH là \(Al_2O_3\)
2.\(\rightarrow\%S=100-60=40\%\)
\(S_xO_y\)
\(x:y=\dfrac{40}{32}:\dfrac{60}{16}=1,25:3,75=1:3\)
Vậy CTHH là \(SO_3\)
3.
a.b.
\(n_{Fe}=\dfrac{11,2}{56}=0,2mol\)
\(n_{H_2SO_4}=2.0,2=0,4mol\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
0,2 < 0,4 ( mol )
0,2 0,2 0,2 0,2 ( mol )
\(V_{H_2}=0,2.22,4=4,48l\)
Chất dư là H2SO4
\(m_{H_2SO_4\left(dư\right)}=\left(0,4-0,2\right).98=19,6g\)
c.Nồng độ gì bạn nhỉ?

Gọi công thức hóa học của oxit là: S x O y
PTK của S x O y là: 32.x + 16.y (đvC)
Theo đề bài oxi chiếm 60% về khối lượng nên ta có:
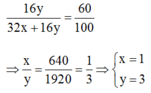
Vậy công thức hóa học của oxit là S O 3

Gọi công thức hóa học của oxit là: \(S_xO_y\)
\(PTK\) của \(S_xO_y\) là \(32x+16y\)
Theo đề bài oxi chiếm 60% về khối lượng nên ta có:
\(\dfrac{16y}{32x+16y}=\dfrac{60}{100}\)
\(\Rightarrow\dfrac{x}{y}=\dfrac{640}{1920}=\dfrac{1}{3}\Leftrightarrow\left[{}\begin{matrix}x=1\\y=3\end{matrix}\right.\)
Vậy CTHH của oxit là: \(SO_3\)