Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\\ n_S=\dfrac{4,8}{32}=0,15\left(mol\right)\)
PTHH: Fe + S --to--> FeS (1)
LTL: \(0,2>0,15\rightarrow\) Fe dư
Theo pthh (1):
\(n_{Fe\left(pư\right)}=n_{FeS}=n_S=0,15\left(mol\right)\\ \rightarrow\left\{{}\begin{matrix}m_{Fe\left(dư\right)}=\left(0,2-0,15\right).56=2,8\left(g\right)\\m_{FeS}=0,15.88=13,2\left(g\right)\end{matrix}\right.\)
PTHH:
FeS + 2HCl ---> FeCl2 + H2S
0,15 0,15
Fe + 2HCl ---> FeCl2 + H2
0,05 0,05
\(\rightarrow M_Z=\dfrac{0,15.34+0,05.2}{0,15+0,05}=26\left(\dfrac{g}{mol}\right)\)
=> dZ/H2 = \(\dfrac{26}{2}=13\)

a)
\(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\); \(n_S=\dfrac{1,6}{32}=0,05\left(mol\right)\)
PTHH: Zn + S --to--> ZnS
Xét tỉ lệ: \(\dfrac{0,1}{1}>\dfrac{0,05}{1}\) => Zn dư, S hết
Các PTHH:
Zn + S --to--> ZnS
ZnS + 2HCl --> ZnCl2 + H2S
Zn + 2HCl --> ZnCl2 + H2
B chứa H2, H2S
b)
PTHH: Zn + S --to--> ZnS
0,05<-0,05-->0,05
ZnS + 2HCl --> ZnCl2 + H2S
0,05-->0,1----->0,05--->0,05
Zn + 2HCl --> ZnCl2 + H2
0,05-->0,1----->0,05-->0,05
=> nHCl = 0,1 + 0,1 = 0,2 (mol)
\(C\%_{dd.HCl}=\dfrac{0,2.36,5}{100}.100\%=7,3\%\)
c) \(\%V_{H_2S}=\%V_{H_2}=\dfrac{0,05}{0,05+0,05}.100\%=50\%\)
d) \(\overline{M}=\dfrac{0,05.2+0,05.34}{0,05+0,05}=18\left(g/mol\right)\)
=> \(d_{B/H_2}=\dfrac{18}{2}=9\)

a.\(Fe+S\rightarrow\left(t^o\right)FeS\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(FeS+2HCl\rightarrow FeCl_2+H_2S\)
b.\(n_{hhk}=\dfrac{4,48}{22,4}=0,2mol\)
\(Fe+S\rightarrow\left(t^o\right)FeS\)
Ta thu được hh khí --> S hết, Fe dư
Gọi \(\left\{{}\begin{matrix}n_{Fe}=x\\n_S=y\end{matrix}\right.\)
\(\rightarrow n_{FeS}=n_{Fe}=n_S\rightarrow n_{Fe\left(dư\right)}=x-y\) ( mol )
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(x-y\) \(x-y\) ( mol )
\(FeS+2HCl\rightarrow FeCl_2+H_2S\)
y y ( mol )
Ta có: \(\left(x-y\right)+y=0,2\)
\(\Leftrightarrow x=0,2\)
Ta có:\(56x+32y=14,4\)
\(\Leftrightarrow56.0,2+32y=14,4\)
\(\Leftrightarrow y=0,1\)
\(\rightarrow\left\{{}\begin{matrix}\%m_{Fe}=\dfrac{0,2.56}{14,4}.100=77,77\%\\\%m_S=100\%-77,77\%=22,23\%\end{matrix}\right.\)

A + H2SO4 → Hỗn hợp khí ⇒ Fe dư; khí Y gồm: H2 ( x mol) và H2S (y mol)
⇒ x + y = 0,1 mol (1)
Bảo toàn S: nH2S = nFeS = nS = y mol
nFe dư = nH2 = x
Bảo toàn Fe: nFe = nFeS + nFe dư = x + y
mX = 56(x + y ) + 32y = 7,2g (2)
Từ (1)(2) ⇒ x = 0,05 mol; y = 0,05 mol
MY = mY : nY = (0,05.2 + 0,05.34) : 0,1 = 18 ⇒ dY/H2 = 9
Gọi \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{FeS}=b\left(mol\right)\end{matrix}\right.\left(đk:a,b>0\right)\)
TH1: S dư
Vậy toàn bộ lượng khí sinh ra là H2S
\(d_{Y\text{/}H_2}=d_{H_2S\text{/}H_2}=\dfrac{34}{2}=17\)
TH2: Fe dư
\(n_{khí}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Bảo toàn KL: \(m_A=m_X=7,2\left(g\right)\)
PTHH:
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
a----------------------------->a
\(FeS+2HCl\rightarrow FeCl_2+H_2S\uparrow\)
b-------------------------------->b
Ta có hệ phương trình: \(\left\{{}\begin{matrix}56a+88b=7,2\\a+b=0,1\end{matrix}\right.\)
\(\Leftrightarrow a=b=0,05\left(TM\right)\)
\(M_Y=\dfrac{0,05.\left(2+34\right)}{0,1}=18\left(g\text{/}mol\right)\\ \rightarrow d_{Y\text{/}H_2}=\dfrac{18}{2}=9\)

Theo đề bài cho, bột S dư nên Fe và Zn tác dụng hết với S.
Phương trình hóa học của phản ứng:
Zn + S → ZnS
Fe + S → FeS
ZnS + H2SO4 → ZnSO4 + H2S
FeS + H2SO4 → H2S + FeSO4

- Chất rắn không tan trong HCL dư là S => m S dư = 3,8g
Kết tủa đen là CuS => n CuS = 0,1 = n H 2 S = nS phản ứng
m S phản ứng = 3,2g
0,2 mol Z gồm 0,1 mol H 2 S và 0,1 mol H 2
m ban đầu = 3,8 + 3,2 = 7g
Ta lại có
n Fe p / u = n S p / u = 0,1 mol
n Fe dư = n H 2 = 0,1 mol
n Fe ban đầu → m Fe ban đầu = 0,2 .56 = 1,12 g
Vậy m = 11,2 + 0,7 = 18,2 (gam)

Theo đề bài ta có bột S dư nên Fe, Zn tác dụng hết với S.
a)Phương trình hóa học của phản ứng.
Zn + S -> ZnS Fe + S -> FeS
x mol x mol y mol y mol
ZnSO4 + H2SO4 -> ZnSO4 + H2S
x mol x mol
FeSO4 + H2SO4 -> FeSO4 + H2S
x mol y mol
Ta có hệ phương trình :
Giải hệ phương trình => x = 0,04 (mol), y = 0,02 (mol).
Vậy mZn = 0,04.65 = 2,6g
mFe = 0,02.56 = 1,12g.

\(n_{Fe}=\dfrac{16,8}{56}=0,3mol\)
\(n_S=\dfrac{6,4}{32}=0,2mol\)
\(Fe+S\rightarrow FeS\)
0,3 0,2 0,2
Sau phản ứng Fe dư và dư 0,1mol.
\(FeS+2HCl\rightarrow FeCl_2+H_2S\uparrow\)
0,2 0,2
\(Fe_{dư}+2HCl\rightarrow FeCl_2+H_2\uparrow\)
0,1 0,1
\(\Sigma n_{khí}=0,2+0,1=0,3mol\)
\(\Rightarrow V_{khí}=0,3\cdot22,4=6,72l\)
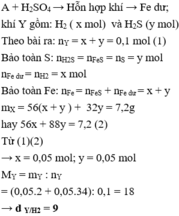

a)
Fe + S --to--> FeS
Fe + 2HCl --> FeCl2 + H2
FeS + 2HCl --> FeCl2 + H2S
\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\); \(n_S=\dfrac{4,8}{32}=0,15\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{0,1}{1}< \dfrac{0,15}{1}\) => Fe hết, S dư
=> Chất sau khi nung gồm FeS, S dư
b)
PTHH: Fe + S --to--> FeS
0,1->0,1------->0,1
FeS + 2HCl --> FeCl2 + H2S
0,1-------------------->0,1
=> Y là H2S
VH2S = 0,1.22,4 = 2,24 (l)
c) Z là S
mS = (0,15 - 0,1).32 = 1,6 (g)