Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
nKMnO4 = 47.4/158 = 0.3 (mol)
2KMnO4 -to-> K2MnO4 + MnO2 + O2
0.3_________________________0.15
VO2 = 0.15*22.4 = 3.36 (l)
b)
nKMnO4 = 31.6/158 = 0.2 (mol)
2KMnO4 -to-> K2MnO4 + MnO2 + O2
0.2_________________________0.1
VO2 = 0.1*22.4 = 2.24 (l)
c)
nKMnO4 = 39.5/158 = 0.25 (mol)
2KMnO4 -to-> K2MnO4 + MnO2 + O2
0.25_________________________0.125
VO2 = 0.125*22.4 = 2.8 (l)
2)
a)
nO2 = 3.36/22.4 = 0.15 (mol)
2KMnO4 -to-> K2MnO4 + MnO2 + O2
0.3_________________________0.15
mKMnO4 = 0.3*158 = 47.4(g)
b)
nO2 = 8.96/22.4 = 0.4 (mol)
2KMnO4 -to-> K2MnO4 + MnO2 + O2
0.8_________________________0.4
mKMnO4 = 0.8*158 = 126.4(g)
c)
nO2 = 14.4/32 = 0.45 (mol)
2KMnO4 -to-> K2MnO4 + MnO2 + O2
0.9_________________________0.45
mKMnO4 = 0.9*158 = 142.2(g)

Câu 7: \(n_{Al}=\dfrac{2,7}{27}=0,1\left(mol\right);n_S=\dfrac{0,32}{32}=0,01\left(mol\right)\)
\(Al\rightarrow Al^{3+}+3e\) \(8H^++SO_4^{2-}+6e\rightarrow S+4H_2O\)
\(4H^++SO_4^{2-}+2e\rightarrow SO_2+2H_2O\)
Bảo toàn e : \(n_{SO_2}.2+n_S.6=n_{Al}.3\)
=> \(n_{SO_2}=\dfrac{0,1.3-0,01.6}{2}=0,12\left(mol\right)\)
=> \(V_{SO_2}=2,688\left(l\right)\)
\(n_{H_2SO_4}=\dfrac{0,01.8+0,12.4}{2}=0,28\left(mol\right)\)
Mình bị nhầm chỗ số mol H2SO4 nha
Sửa lại : \(n_{H^+}=4n_{SO_2}=0,6\left(mol\right)\)
Do H2SO4 ---------> 2H+ + SO42-
=> \(n_{H_2SO_4}=\dfrac{1}{2}n_{H^+}=0,3\left(mol\right)\)

\(n_{SO_2}=\dfrac{2,8}{22,4}=0,125mol\)
\(S+O_2\rightarrow\left(t^o\right)SO_2\)
0,125 0,125 ( mol )
\(2KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\)
0,25 0,125 ( mol )
\(m_{KMnO_4}=0,25.158=39,5g\)
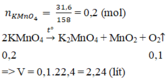
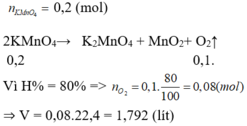

Đáp án A