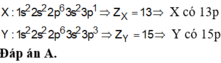Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án : D
X có e cuối thuộc phân lớp s => nhóm A(I hoặc II)
Y có e cuối thuộc phân lớp p => nhóm A (III à VIII)
, eX + eY = 20 => pX + pY = 20
Ta có : X chỉ có thể là : H( p =1) ; He (p =2) ; Na(p = 11) và K(p = 19)
=> Ta thấy Chỉ có Na (p = 11) => pY = 9 (Flo) thỏa mãn
=> X – Y : NaF ( liên kết ion )

Chi có K và Ca, còn lại các nguyên tố nhóm B đều có e cuối điền vào 3d chứ không phải 4s
=> Đap an C

Đáp án A
Các có electron cuối cùng điền vào phân lớp 2s là:
1s2 2s1
1s2 2s2
→ Có 2 nguyên tố thỏa mãn

Đáp án : B
Có 2 nguyên tố là Bo ( 1s22s1 ) và He (1s22s2 )

Chọn A.
- Y có cấu hình e là : 1s22s22p63s23p1. Y là Al.
- Với X, do ep= 2n+1 ≤ 6 và 2≤ n (n=2 trở lên mới có phân lớp p)nên n=2
→ X có cấu hình e là : 1s22s22p5. X là F. Số oxi hóa cao nhất của F trong hợp chất là -1.

Đáp án : D
Hợp chất của Y với H là H2Y => Y thuộc nhóm VIA ( 3s23p4) [ có 2e độc thân ]
Vì phân lớp 3s của X và Y hơn kém nhau 1e => X : 3s1 => X là kim loại kiềm (IA)
[ có 1 e độc thân

Đáp án A
Tổng số e trong phân lớp p là 7 => Al
=> tổng số hạt mang điện = 13 + 13 = 26
Trong Y:
Tổng số hạt mang điện = 26 + 8 = 34
=> Z =p = e = 17 => Y là Cl