Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Do phần 1 td với NaOH sinh ra khí nên có chứa Al => Mỗi phần gồm: Al dư, Al2O3 và Fe
2Al+Fe2O3→Al2O3+2Fe
P1: nAl=nH2/1,5=4/15 mol
Đặt nAl2O3 = x => nFe = 2x
m1 = (4/15).27+102x+56.2x = 214x+7,2
%mFe = 56.2x/(214x+7,2) = 0,448 => x = 0,2 mol
=>m1 = 214.0,2+7,2 = 50 gam
Giả sử cho phần 1 tác dụng với HCl dư: nH2 = nFe + 1,5nAl = 0,4+1,5.(4/15) = 0,6 mol
Ta thấy:
m1 = 50 gam tác dụng với HCl sinh ra 0,8 mol H2
m2 0,12 mol
=> m2=7,5 gam
BTKL => m = m1+m2 = 57,5 gam
Đáp án A

Giải thích:
Do phần 1 td với NaOH sinh ra khí nên có chứa Al => Mỗi phần gồm: Al dư, Al2O3 và Fe
2Al+Fe2O3→Al2O3+2Fe
P1: nAl=nH2/1,5=4/15 mol
Đặt nAl2O3 = x => nFe = 2x
m1 = (4/15).27+102x+56.2x = 214x+7,2
%mFe = 56.2x/(214x+7,2) = 0,448 => x = 0,2 mol
=>m1 = 214.0,2+7,2 = 50 gam
Giả sử cho phần 1 tác dụng với HCl dư: nH2 = nFe + 1,5nAl = 0,4+1,5.(4/15) = 0,6 mol
Ta thấy:
m1 = 50 gam tác dụng với HCl sinh ra 0,8 mol H2
m2 0,12 mol
=> m2=7,5 gam
BTKL => m = m1+m2 = 57,5 gam
Đáp án A


Giải hệ 3 phương trình 3 ẩn trên ta được:
a = 0,2 mol; k = 0,15
→ m2= 0,15m1
→ m = 1,15.m1 = 57,5g

Đáp án C
Cr2O3 + 2Al → t 0 Al2O3 + 2Cr
Phần 2: + NaOH đặc nóng → 0,075 mol H2
![]()
Phần 1: + HCl loãng, nóng → 0,15 mol H2
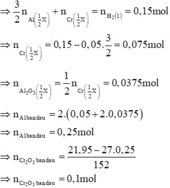
Có 0 , 1 1 < 0 , 25 2 => tính hiệu suất theo lượng Cr2O3 phản ứng.
![]()

Giải thích:
Ở phần 1 khi cho tác dụng với NaOH có sinh ra khí H2 => nhôm dư
Phần 1
nH2 = 0,0525 mol => nAl dư = 0,035 mol
chất rắn không tan tác dụng với HCl => nH2 = 0,045 mol => nFe = 0,045 mol
Phần 2
nH2 = 0,2925 mol
Giả sử phần 2 = k. phần 1
Bảo toàn e ở phần 2 ta có (3 . 0,035 + 2 . 0,045) . k = 2 . 0,2925 => k = 3
Có mA = mB = 4 khối lượng phần 1
=> tổng lượng H2 ở thí nghiệm 1 = 4 . (0,0525 + 0,045 ) = 0,39
=> nFe3O4 = (4 . 0,045) : 3 = 0,06 mol
=> 3nAl = 2.nFe3O4 + 2nH2 => nAl = 0,3 mol
=> mA = 0,3 . 27 + 0,06 . 232 = 22,02 mol
%Al = 37% và %Fe3O4 = 63%
Đáp án A

Đáp án A
· Có n Al ( B ) = 2 3 . n H 2 = 2 3 . 0 , 672 22 , 4 = 0 , 02 mol
· Chất rắn thu được sau khi nung là Al2O3:
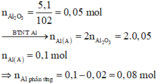
· Quy đổi A tương đương với hỗn hợp gồm 0,1 mol Al, a mol Fe, b mol O
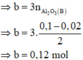
· Phần không tan D gồm Fe và oxit sắt + H2SO4 ® Dung dịch E + 0,12 mol SO2
Dung dịch E chứa một muối sắt duy nhất và không hòa tan được bột Cu
Þ Muối sắt là FeSO4.
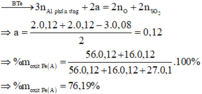

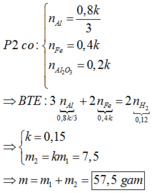


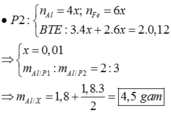
Đáp án A
Do phần 1 td với NaOH sinh ra khí nên có chứa Al => Mỗi phần gồm: Al dư, Al2O3 và Fe
2Al+Fe2O3→Al2O3+2Fe
P1: nAl = nH2/1,5=4/15 mol
Đặt nAl2O3 = x => nFe = 2x
m1 = (4/15).27+102x+56.2x = 214x+7,2
%mFe = 56.2x/(214x+7,2) = 0,448 => x = 0,2 mol
=>m1 = 214.0,2+7,2 = 50 gam
Giả sử cho phần 1 tác dụng với HCl dư:
nH2 = nFe + 1,5nAl = 0,4+1,5.(4/15) = 0,6 mol
Ta thấy: m1 = 50 gam tác dụng với HCl sinh ra 0,8 mol H2
m2 = 0,12 mol => m2=7,5 gam
BTKL => m = m1+m2 = 57,5 gam