Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Giải:
Phần 1: có H2 thoát ra => Al dư . nAl dư = 2/3 nH2 = 0,03
Chất rắn không tan là Fe , nFe = 0,09 => tỉ lệ mol Al và Fe là 1:3 Phần 2 : Đặt nAl=a , nFe=b
Ta có : 3a=b , 3a+3b=3nNO= 1,08 => a=0,09 ; b=0,27 => nAl2O3 = 0,12
Tỉ lệ mol của Al và Al2O3 là 3:4 => nAl2O3 trong phần 1 = 4/3 nAl=0,04
Vậy m = mAl + mFe + mAl2O3 = 0,03.27+0,04.102+5,04+29,79=39,72g
nFe = 0,09 ; nO=3 nAl2O3=0,12 => nFe:nO=3/4 => oxit sắt là Fe3O4

Đáp án B
P1 : + NaOH có khí H2 => Al dư , FexOy hết
=> mFe = 5,04g => nFe = 0,09 mol ; nAl dư = 0,03 mol = 2/3nH2
=> nFe + nAl = 0,12 mol
P2 : Fe và Al phản ứng tạo NO => nFe + nAl = nNO (bảo toàn e) = 0,36 mol = 3nP1
=> mP1 = 1/3mP2 = 9,93g => m = 9,93 + 29,79 = 39,72g
Xét P1 : mAl2O3 + mFe + mAl = mP1 = 9,93g => nAl2O3 = 0,04 mol => nO = 0,12 mol
=> nFe : nO = 0,09 : 0,12 = 3 : 4 => Fe3O4
=>B

Đáp án B
Quy đổi phần 1: thành 3 nguyên tố Al, Fe, O với số mol tương ứng là x, y, z.
27x + 56y + 16z = 14,49. (1)
Khi tác dụng với HNO3 dư thu khí NO: 0,165 mol.
Bảo toàn electron: 3x + 3y – 2z = 3nNO
3x + 3y – 2z = 3.0,165 = 0,495 (2)
Quy đổi phần 2: Al, Fe, O với số mol tương ứng là:kx, ky, kz
( Vì đề bài cho hai phần không bằng nhau)
Khi tác dụng với NaOH . Fe không phản ứng.
Bte: 3nAl – 2nO = 2nH2
3kx – 2kz = 0,03 (3)
Rắn còn lại là Fe: ky = 0,045 (4).
Lấy (3)/(4) → 3 x - 2 z y = 2 3 → 9x -2y – 6z – 0(4)
→ x = 0,15, y = 0,135, z = 0,18
Công thức oxit: y 2 = 0 , 135 0 , 18 = 3 4 → F e 3 O 4
(4) → k = 0 , 045 0 , 135 = 1 3
m d a u = m 1 + m 2 = m 1 + m 1 3 = 4 m 1 3 = 27 . 0 , 15 + 56 . 0 , 135 + 16 . 0 , 18 . 4 3 = 19 , 32 g

Phần 2:
nFe = 2,52/56=0,045 ; nAl = 2/3 nH2=0,01
=> nFe:nAl=9:2
Phần 1 :
Giả sử nFe=9x, nAl=2x
Ta có : 3nNO=3nFe+3nAl => 3(9x+2x)=3.0,165
=> x= 0,015 => nFe=0,135; nAl=0,03
=> nAl2O3=(14,49-0,135.56-0,03.27)/102=0,06
=>nFe:nO=3:4 => oxit sắt là Fe3O4
nFe: nAl2O3 = 9:4 => nAl2O3(phần 1)=0,02
=> X gồm 0,2 mol Al và 0,06 mol Fe3O4
=> m= 0,2.27+0,06.232=19,32g
=> Đáp án B

Đáp án B
Nhiệt phân hoàn toàn X ⇒ Y gồm Fe, Al2O3 và Al dư.
► Xét phần 2: nAl = nH2 ÷ 1,5 = 0,01 mol; nFe = 0,045 mol
⇒ ne cho TỐI ĐA = 0,01 × 3 + 0,045 × 3 = 0,165 mol.
||⇒ phần 1 gấp 0,165 × 3 ÷ 0,165 = 3 lần phần 2.
► Xét phần 1: chứa 0,03 mol Al; 0,135 mol Fe.
||⇒ nAl2O3 = (14,49 – 0,03 × 27 – 0,135 × 56) ÷ 102 = 0,06 mol.
⇒ nO = 0,18 mol ⇒ x : y = 0,135 ÷ 0,18 = 3 : 4 ⇒ Fe3O4.
● m = 4 3 × 14,49 = 19,32(g)

Phần 2 => mol Al = 0,01 ; mol Fe = 0,045 => ti lệ Al : Fe = 2/9
Đặt a, b, c là mol Al2O3 ; Al ; Fe
102a + 27b + 56c = 14,49
3b + 3c = 0,165*3
9b - 2c = 0
=> a = 0,06 ; b = 0,03 ; c = 0,135 => CT oxit sắt: Fe3O4
và phần 1 = 3*phần 2 => mol Al = 0,01 ; mol Fe = 0,045
=> ti lệ Al : Fe = 2/9 Đặt a, b, c là mol Al2O3 ; Al ; Fe
102a + 27b + 56c = 14,49 3b + 3c = 0,165*3
9b - 2c = 0
=> a = 0,06 ; b = 0,03 ; c = 0,135 => CT oxit sắt: Fe3O4
và phần 1 = 3*phần 2 => m = 19,32 2 => m = 19,32
=> Đap an B

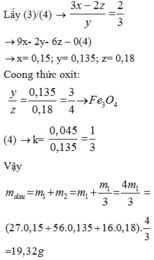
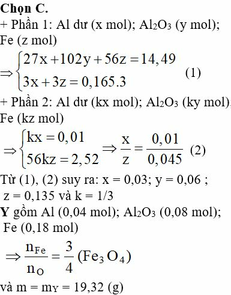

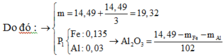
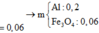
Chọn đáp án B.