Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Vì khối lượng của hỗn hợp trước và sau phản ứng là bằng nhau
=> n hh trước phản ứng : n hh sau phản ứng = 25 : 15 = 5 : 3
Coi tổng số mol trước phản ứng là 5 => tổng số mol sau phản ứng là 3 mol
Ta có khối lượng hỗn hợp là : 5 . 15 = 75 g
Ta có hệ :
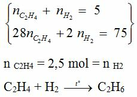
Ban đầu 2,5 2,5
Phản ứng x x
Kết thúc : 2,5 – x 2,5– x x
=> Tổng số mol sau phản ứng là : : 2,5 – x + 2,5– x + x = 5–x
=> 5 – x = 3 => x = 2 mol
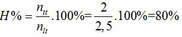

5.
\(n_X=\dfrac{2,24}{22,4}=0,1mol\\ M_X=2,125.4=8,5g\cdot mol^{^{ }-1}\\ n_{H_2}=a;n_{C_2H_4}=b\\ a+b=0,1\\ 2a+28b=8,5.0,1=0,85\\ a=0,075;b=0,025\\ H_2+C_2H_4-^{^{ }Ni,t^{^{ }0}}->C_2H_6\\ V_{C_2H_6}=0,025.22,4=0,56L;V_{H_2dư}=22,4\left(0,075-0,025\right)=1,12L\)
6.
Thu được Y chỉ gồm hydrocarbon nên khí hydrogen phản ứng hết.
\(n_A=\dfrac{4,48}{22,4}=0,2mol\\ n_Y=\dfrac{3,36}{22,4}=0,15mol\\ \Delta n_{hh}=n_{H_2\left(pư\right)}=0,05\left(mol\right)\\ n_{C_2H_4}=0,15\left(mol\right)\\ a.\%V_{H_2}=\dfrac{0,05}{0,2}=25\%\\ \%V_{C_2H_4}=75\%\\ b.BTLK\pi:0,15=0,05+n_{Br_2}\\ n_{Br_2}=0,1mol\)

Ta có :
\(m_{hỗn\ hợp} = n.M = \dfrac{2,24}{22,4}.2.7,56 = 1,521(gam)\)
Bảo toàn khối lượng , sau khi nung : m = 1,521(gam)
\(\Rightarrow n_{hỗn\ hợp\ sau} = \dfrac{1,521}{2.8,4} = 0,09(mol)\)
Ta có :
\(\dfrac{p_{trước}}{p_{sau}} = \dfrac{n_{trước}}{n_{sau}}\)
⇔ \(\dfrac{1}{p_{sau}} = \dfrac{0,1}{0,09}\\ \Rightarrow p_{sau} = 0,9\ atm\)

Tính nX= 0,8 mol; nZ= 0,3 mol; MY= 29 g/mol; MZ= 18,3332 g/mol
MX= \(\dfrac{\text{44.1 + 52.1+40.3+28.2+2.9}}{16}\) = 18,125 g/mol
Các hidrocacbon không no đều có chỉ số H= 4 nên đặt công thức chung là CxH4.
*Phản ứng của X với Ni nung nóng:
CxH4+ y H2 → CxH4+2y (1)
Theo bảo toàn khối lượng ta có: mY= mX= 0,8.18,125= 14,5 gam
→ nY= 14,5 : 29= 0,5 mol
Theo phản ứng (1) thấy số mol khí giảm xuống bằng số mol H2 phản ứng
Vậy nH2 phản ứng= 0,8- 0,5= 0,3 mol
*Phản ứng của Y với dung dịch Br2 dư:
Y gồm Z (C3H8, C2H6, C4H10) và các hidrocacbon không no: CnHm
CnHm+ a Br2 → CnHmBr2a (2)
Khối lượng bình brom tăng lên bằng khối lượng hidrocacbon không no trong Y
Bảo toàn khối lượng ta có: mZ+ mCnHm= mY
Nên mbình brom tăng= mCnHm= mY- mZ= 14,5- 0,3.4.4,5833= 9 gam
Xét cả quá trình thì toàn bộ liên kết kém bền đều bị đứt hết
Đặt công thức chung của H2 phản ứng và Br2 phản ứng là X2.
C4H4+ 3X2 → C4H4X6
C3H4+ 2X2 → C3H4X4
C2H4+ X2 → C2H4X2
Tổng số mol liên kết kém bền trong X là n
Ta có: nX2= 3.nC4H4+ 2.nC3H4 + nC2H4= 3.1+2.3+216.0,8=0,55(mol)
Nên nBr2 pứ= nX2- nH2 pứ= 0,55- 0,3= 0,25 mol

Ta có MX = 3,6.2 =7,2.
Áp dụng qui tắc đường chéo :
=> nH2 : nN2 = 4 : 1
Đặt nH2 = 4 mol => nN2 = 1 mol
N2 + 3H2 ---> 2NH3
x----->3x-------->2x
=> nY = 5 – 2x mol
Bảo toàn khối lượng :
mX = mY = 4.2 + 1.28 = 36g
=> MY = 4.2 = \(\dfrac{36}{5-2x}\)
=> x = 0,25 mol
Tính hiệu suất theo N2 => H = \(\dfrac{0,25}{1}\)= 25%


trong 1 mol hh ban đầu có nH2 =0,75 mol , nC2H4 =0,25 mol
nsau= 2,125.13/34=0,8125
=> nH2 pứ =ntrc -nsau =1- 0.8125=0,1875
=> H= 0,1875/0,75 .100= 25%
tại sao trong hỗn hợp khí ban đầu có nH2 =0,75. nH2 sau tính bằng cách nao