Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Gọi công thức TB của hai muối cacbonat là: M ¯ C O 3
M ¯ C O 3 → t 0 M O + C O 2 ( 1 )
Chất rắn Y ( M ¯ C O 3 ; M ¯ O )
n C O 2 ( 1 ) = 3 , 36 22 , 4 = 0 , 15 m o l
Y tác dụng với dung dịch HCl dư
M ¯ C O 3 + 2 H C l → t 0 M ¯ C l 2 + C O 2 + H 2 O ( 2 ) M ¯ O + H C l → t 0 M ¯ C l 2 + H 2 O ( 3 ) C O 2 + B a ( O H ) 2 → B a C O 3 + H 2 O ( 4 ) 2 C O 2 + B a ( O H ) 2 → B a ( H C O 3 ) 2 ( 5 ) B a ( H C O 3 ) 2 → t 0 B a C O 3 + C O 2 + H 2 O ( 6 ) n B a C O 3 ( 4 ) = 9 , 85 197 = 0 , 05 m o l n B a C O 3 ( 6 ) = 9 , 85 197 = 0 , 05 m o l
Theo PT (4,5,6): n C O 2 ( 3 ) = 0 , 15 m o l
Theo PT (1,2):
n M ¯ C O 3 = n C O 2 ( 2 ) + n C O 2 ( 1 ) = 0 , 15 + 0 , 15 = 0 , 3 m o l
Muối khan là: M ¯ C l 2
M ¯ C O 3 → M ¯ C l 2 M ¯ + 60 M ¯ + 71
0,3 mol muối cacbonat pư tạo 0,3 mol muối clorua tăng 3,3(g).
Khối lượng muối cacbonat ban đầu là: 38.15-3,3= 34,85(g)
Giá trị của m = 34,85(g)

nMg=0,5 mol= nMg(NO3)2, nN2O= 0,1 mol
Quá trình cho e:
Mg→ Mg2++ 2e (1)
0,5→ 1 mol
Quá trình nhận e:
2NO3-+ 8e+ 10H+ → N2O + 5H2O (2)
0,8 1,0 0,1 mol
Do số mol e cho ở (1) khác số mol e nhận ở (2) nên phải có quá trình tạo NH4+
Theo ĐLBT e: necho= ne nhận= 1 mol → ne nhận ở (3)= 1-0,8=0,2 mol
NO3-+ 8e+ 10H+ → NH4+ + 3H2O (3)
0,2 0,25 0,025 mol
Vậy cô cạn X thu được 2 muối là 0,5 mol Mg(NO3)2 và 0,025 mol NH4NO3→m=76 gam
Đáp án B

Đáp án D
Đặt công thức của hai muối là RCO3: x mol
RCO3+ 2HCl → RCl2+ CO2+ H2O
x 2x x x mol
Theo định luật bảo toàn khối lượng:
mmuối cacbonat+ mHCl= m muối clorua+ mCO2+ mH2O
→ 7,0 + 2x. 36,5=9,2+ 44x+18x → x= 0,2 mol→ VCO2= 0,2.22,4= 4,48 lít

Đáp án A
nN2 = 0,672 : 22,4 = 0,03 (mol)
Nếu N+5 → N2 thì nNO3- TRONG MUỐI = 10nN2 = 0,03.10 = 0,3 (mol)
BTKL: mMUỐI = mKL + mNO3- = 7,5 + 0,3.62 = 26,1 # 54, 9(g) => có tạo muối NH4+
Gọi nMg = a mol; nAl = b mol; nNH4+ = c mol
∑ mX = 24x + 27y = 7,5 (1)
∑ ne( KL nhường ) = ∑ nN+ 5( nhận) <=> 2x + 3y = 8c +10.0,03 (2)
∑ mmuối = 148a + 213b + 80c = 54,9 ( 3)
Từ (1), (2), (3) => a = 0,2 ; b = 0,1; c = 0,05 mol
CT nhanh: nHNO3 = 10nNH4+ + 12nN2 = 10. 0,05 + 12. 0,03 = 0,86 (mol)
=> VHNO3 = 0,86 (lít)
Chú ý:
Tạo muối NH4+

Đặt nN2O= x mol; nN2= y mol
Ta có nhhY= x+y= 1,12/ 22,4= 0,05 mol
mhhY=44x + 28y= 0,05.18.2
Giải hệ trên được x= 0,025 và y= 0,025
nZn= 0,3 mol= nZn(NO3)2
Quá trình cho e:
Zn→ Zn2++ 2e (1)
0,3→ 0,6 mol
Quá trình nhận e:
2NO3-+ 10e+ 12H+ → N2 + 6H2O (2)
0,25 ← 0,025 mol
2NO3-+ 8e+ 10H+ → N2O + 5H2O (3)
0,2 ← 0,025 mol
Tổng số mol e nhận ở (2) và (3) là ne nhận= 0,25+ 0,2= 0,45 mol <0,6 mol
Do đó còn xảy ra quá trình nhận e: ne nhận ở (4)= 0,6- 0,45= 0,15mol
NO3-+ 8e+ 10H+ → NH4++ 3H2O (4)
0,15 → 0, 01875 mol
Dung dịch X chứa 0,3 mol Zn(NO3)2 và 0,01875 mol NH4NO3
→m=0,3.189+ 0,01875.80=58,2 gam
Đáp án B

Đáp án C
Gọi công thức của hai muối trong hỗn hợp ban đầu là A2CO3 và BCO3.
Có các phản ứng:
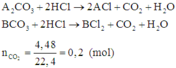
Quan sát phản ứng thấy khi cho hỗn hợp phản ứng với dung dịch HCl thì mỗi gốc C O 3 2 - trong muối được thay thế bởi hai gốc Cl-.
Có 1 mol C O 3 2 - bị thay thế bởi 2 mol Cl- thì khối lượng của muối tăng: (2.35,5 -60) = 11(gam)
Do đó khối lượng muối khan thu được khi cô cạn dung dịch là:
mmuối clorua = mmuối cacbonat + 0,2.11 = 23,8 + 0,2.11= 26 (gam)

Đáp án B
Gọi công thức trung bình của hai muối ACO3 và BCO3 là MCO3
MCO3 → MO + CO2
n C O 2 = 3,36 /22,4 = 0,15 mol → n M C O 3 = 0,15 mol
Hỗn hợp Y gồm MCO3 dư và MO
MCO3 + 2HCl → MCl2 + CO2 + H2O
MO + 2HCl → MCl2 + H2O
CO2 + Ca(OH)2 dư → CaCO3 ↓ + H2O
n C a C O 3 = 15/100 = 0,15 mol
→ n M C O 3 dư = 0,15 mol
n M C O 3 ban đầu = 0,15 + 0,15 = 0,3 mol
Bảo toàn kim loại M có:
n M C O 3 = n M C l 2 = 0,3 (mol)
Bảo toàn khối lượng có:
m M C O 3 = m M C l 2 - 0,3.(71- 60) = 29,2 (gam)
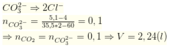
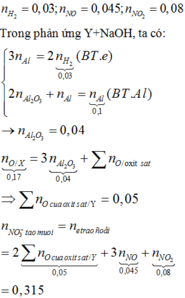
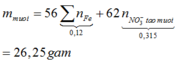
Đáp án C