Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án B
nAl = 0,02 mol; nZn = 0,05 mol; nNaOH = 0,485 mol.
NaOH + Y → dung dịch trong suốt {NaAlO2, Na2ZnO2, NaNO3}
Bảo toàn nguyên tố Natri: nNO3–/Y = nNaNO3 = 0,365 mol.
► Hòa tan "hoàn toàn" ⇒ HNO3 dư hoặc đủ, kim loại hết.
Đặt nNH4+ = x; nN2 = y. Bảo toàn electron:
8x + 10y = 0,02 × 3 + 0,05 × 2. Bảo toàn nguyên tố Nitơ:
∑nN/spk = 0,394 - 0,365 = x + 2y || Giải hệ có:
⇒ x = 0,005 mol; y = 0,012 mol ⇒ V = 268,8 ml ⇒ chọn B.

Đáp án A
Bảo toàn H có n H 2 O = n a x i t = 0,32 mol.
Bảo toàn O có:
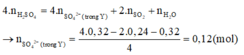
Cho NaOH phản ứng hết với Y, sau phản ứng dung dịch thu được chứa: N a + : 0,25 mol; S O 4 2 - : 0,12 mol; Al O 2 - x mol.
Bảo toàn điện tích → x = 0,25 – 2.0,12 = 0,01 (mol)
n O H - t r o n g ↓ = n O H - b a n đ ầ u – 4.nAl O 2 - = 0,25 – 4.0,01 = 0,21 (mol)
m K L t r o n g ↓ = m ↓ - m O H - t r o n g ↓ = 7,63 – 0,21.17 = 4,06 gam.
Bảo toàn S có:
n S t r o n g F e S + n S t r o n g a x i t = n S t r o n g k h ô n g k h í + n S t r o n g S O 4 2 - ở Y
→ n S t r o n g F e S = 0,24 + 0,12 – 0,32 = 0,04 mol
→ m = m K L t r o n g ↓ + m S t r o n g F e S + m A l t r o n g A l O 2 - = 4,06 + 0,04.32 + 0,01.27 = 5,61 gam.

Đáp án D
Gọi số mol của Zn, ZnO, ZnCO3 lần lượt là 3x, x, x (mol)
=> 3x. 65 + 81x + 125x = 24, 06
=> x = 0,06 (mol)
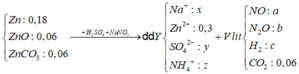
Dd Y + BaCl2 → BaSO4 : 0,34 (mol) => nSO42- =0,34 (mol) = y
Dd Y + NaOH → nOH- max = nOH- + 4 nZn2+ = 1,21 (mol)
=> nNH4+ = 1,21 – 4. 0,3 = 0,01 (mol) = z
Bảo tòan điện tích cho dd Y: ∑ n. điện tích (+) = ∑ n. điện tích (-)
=> nNa+ + 0,3. 2 + 0,01.1 = 0,34.2
=> nNa+ = 0,07 (mol) = x
BTNT N: a + 2b + 0,01 = 0,07 (1)
mT = 30a + 44b + 2c + 44.0,06 = ( a+b + c + 0,06). 436/15 (2)
Hỗn hợp ban đầu quy đổi thành Zn: 0,3 mol; O: 0,12 mol và CO2: 0,06 mol
NO3 - + 4H+ + 3e → NO + 2H2O
2NO3 - + 10H+ + 8e → N2O + 5H2O
2H+ + 2e → H2
∑n H+ = 2n H2SO4 = 4nNO + 10nN2O + 2nH2 = 4a + 10b + 2c = 0,34.2 (3)
Giải hệ (1), (2), (3) được
a = 0,04
b = 0,01
c = 0,04
=> V = (0,04+ 0,01 + 0,04+ 0,06). 22,4 = 3,36 lít gần với 3 nhất

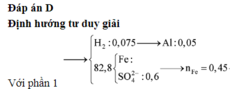
Xét phần 1: do sinh ra H2 ⇒ Al dư. nH2 = 0,075 mol ⇒ nAl dư = 0,05 mol.
Rắn không tan là Fe. Ta có: 2H2SO4 + 2e → SO2 + SO42– + 2H2O.
⇒ nSO42– = nSO2 = 0,6 mol ⇒ nFe = (82,8 – 0,6 × 96) ÷ 56 = 0,45 mol.
8Al + 3Fe3O4 → 4Al2O3 + 9Fe ⇒ nAl2O3 = 0,45 × 4 ÷ 9 = 0,2 mol.
⇒ mphần 1 = 0,05 × 27 + 0,2 × 102 + 0,45 × 56 = 46,95(g) ⇒ m phần 2 = 187,8(g).
⇒ phần 2 gấp 4 lần phần 1 ⇒ phần 2 chứa 0,2 mol Al; 0,8 mol Al2O3; 1,8 mol Fe.
Ta có: nH+ = 4nNO + 2nNO2 + 2nO + 10nNH4+ ⇒ nNH4+ = 0,015 mol.
Đặt nFe(NO3)2 = b ⇒ a + b = nFe = 1,8 mol; Bảo toàn electron:
0,2 × 3 + 3a + 2b = 1,25 × 3 + 1,51 + 0,015 × 8. Giải hệ có: a = 1,18.
Đáp án D

Mình ko phải giáo viên đâu!!!!
Đối với những bài có quá nhiều chất cậu nên quy ước về các nguyên tố rồi áp dụng bảo toàn e là đơn giản nhất!!!![]()
Bài giải:
Fe \(\rightarrow\) Fe+3 + 3e 4H+ + NO3- + 3e => NO +2 H2O
Gọi n Fe= a mol ta có: nNO => nH+ (trong ax) =>nH+ =0,12+0,05 = 0,17 mol
dễ nhận thấy: nH+ (dư) + 3nFe = nNaOH => (0,17-4a) + 3a = 0,13 => a=0,04 mol
=> dd Y có : 0,04 mol Fe3+ và 0,01 mol H+ (dư)
khi cho Cu vào Y thì có các PƯ sau:
Fe3+ + 1e => Fe2+ ; Cu => Cu2+ + 2e ; 4H+ + NO3- + 3e => NO + 2 H2O
áp dụng định luật bảo toàn e ta có: 0,04 + \(\frac{3}{4}\) 0,01 = 0,0475 mol (e nhường) => nCu=0,02375 mol
Vậy m Cu=0,02375.64= 1,52 (g)
bài này nhiều chỗ mình trình bày chưa chặt chẽ mong các bạn và thầy cô đóng góp ý kiến!!!!!!!
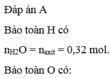



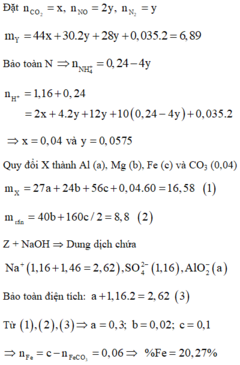
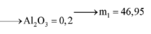
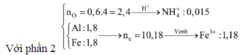
cho mình hỏi một chút sao 0.02x4 + 0.05x4 sao lại nhân 4 ah