Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Mg + 2HCl → MgCl2 + H2 (1)
Al2O3 + 6HCl → 2AlCl3 + 3H2O (2)
nH2 = 2,8/22,4 = 0,125 mol
Theo tỉ lệ phản ứng (1) => nMg = nH2 = 0,125 mol
<=> mMg = 0,125 .24 = 3 gam và mAl2O3 = 8,1 - 3 =5,1 gam
%mMg = \(\dfrac{3}{8,1}\).100% = 37,03% => %mAl2O3 = 100 - 37,03 = 62,97%
b) nAl2O3 = \(\dfrac{5,1}{102}\)= 0,05 mol
=> nHCl pư = 2nMg + 6nAl2O3 = 0,55 mol
mHCl = 0,55.36,5 = 20,075 gam
=> mdung dịch HCl 18% = \(\dfrac{20,075}{18\%}\)= 111,53 gam

\(n_{H2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
a) Pt : \(2Al+2NaOH+2H_2O\rightarrow2NaAlO_2+3H_2|\)
2 2 2 2 3
0,2 0,2 0,3
\(Al_2O_3+2NaOH\rightarrow2NaAlO_2+H_2O|\)
1 2 2 1
0,1 0,2
b) \(n_{Al}=\dfrac{0,3.2}{3}=0,2\left(mol\right)\)
\(m_{Al}=0,2.27=5,4\left(g\right)\)
\(m_{Al2O3}=15,6-5,4=10,2\left(g\right)\)
c) Có : \(m_{Al2O3}=10,2\left(g\right)\)
\(n_{Al2O3}=\dfrac{10,2}{102}=0,1\left(mol\right)\)
\(n_{NaOH\left(tổng\right)}=0,2+0,2=0,4\left(mol\right)\)
\(V_{ddNaOH}=\dfrac{0,4}{1}=0,4\left(l\right)=400\left(ml\right)\)
Chúc bạn học tốt


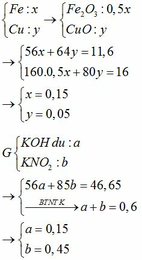
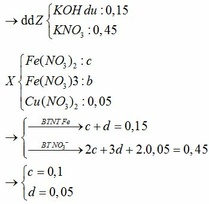

BTKL
mX + mdd HNO3 = mdd X + mH2O + m↑
=> mdd X = 11,6 + 87,5 – 30 . 0,1 – 46 . 0,15 = 89,2g
=> C%Fe(NO3)3 = 13,565%

a.Ta có n HCl = 1 . 0,25 = 0,25 mol
nH2SO4 = 0,5.0.25 = 0,125 mol
==> nH(X) = 0,25 + 0,125.2 = 0,5 mol
nH2 = 4,368/22,4 = 0,195 mol <=> nH= 0,195. 2 = 0,39 mol < 0,5 mol
Vậy sau phản ứng dung dịch B vẫn còn axit dư
b. Gọi số mol của Al và Mg lần lượt là x và y mol
Ta có phương trình 27x + 24y =3,87 (1)
Áp dụng định luật bảo toàn eletron ==> 3x + 2y = 0,195.2 (2)
Từ (1) , (2) ==> \(\left\{{}\begin{matrix}x=0,09\\y=0,06\end{matrix}\right.\)
mAl = 0,09 .27 = 2,43 gam , %mAl trong A = \(\dfrac{2,43}{3,87}\).100=62,8%
==> %mMg trong A = 100 - 62,8 = 37,2%
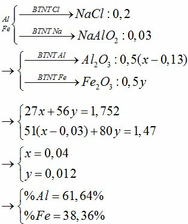

\(2Al+6HCl-->2AlCl_3+3H_2\left(1\right)\)
0,04___ 0,12_________0,04______ 0,06
\(Al_2O_3+6HCl-->2AlCl_3+3H_2O\left(2\right)\)
0,02_____0,13________ 0,04
\(n_{H_2}=\dfrac{1,344}{22,4}=0,06\left(mol\right)\)
\(n_{HCl}=0,25.1=0,25\left(mol\right)\)
=> \(n_{Al}=\dfrac{2}{3}n_{H_2}=\dfrac{2}{3}.0,06=0,04\)
\(n_{HCl\left(1\right)}=2n_{H_2}=2.0,06=0,12\left(mol\right)\)
=> \(n_{HCl\left(2\right)}=0,25-0,12=0,13\left(mol\right)\)
=> \(n_{Al_2O_3}=\dfrac{1}{6}n_{HCl\left(2\right)}=\dfrac{1}{6}.0,13=0,02\left(mol\right)\)
=> \(m_{Al}=0,04.27=1,08\left(gam\right)\)
=> %\(m_{Al}=\dfrac{1,08}{2,1}.100=51,43\%\)
=>%\(m_{Al_2O_3}=100-51,43=48,57\%\)
=> Σ \(n_{AlCl_3}=0,0+0,04=0,08\left(mol\right)\)
=> \(C_M\left(AlCl_3\right)=\dfrac{0,08}{0,25}=0,32\left(M\right)\)
\(AlCl_3+3NaOH-->Al\left(OH\right)_3+3NaCl\left(3\right)\)
0,08_______0,24________0,08
\(n_{Al\left(OH\right)_3}=\dfrac{3,9}{78}=0,05\left(mol\right)\)
=> \(n_{Al\left(OH\right)_3}=n_{AlCl_3}=0,08>0,05\left(mol\right)\)
=> Al(OH)3 bị tan một phần
=> \(n_{Al\left(OH\right)_3}bịtan=0,08-0,05=0,03\left(mol\right)\)
\(NaOH+Al\left(OH\right)_3-->NaAlO_2+2H_2O\left(4\right)\)
0,03______ 0,03
=> Σ \(n_{NaOH}=0,24+0,03=0,27\left(mol\right)\)
=> \(V_{NaOH}=\dfrac{0,27}{1,6}=0,16875\left(l\right)\)