Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Gọi A, B là kí hiệu của 2 kim loại. X là kí hiệu chung của 2 kim loại
Do dung dịch sau phản ứng có nồng độ mol bằng nhau nên ![]()
TH1: Nếu dung dịch chỉ chứa 2 muối
A+2HCl→ACl2+H2
a 2a a a
B+ 2HCl→BCl2+H2
a 2a a a
nHCl = 0,2 × 1,25 = 0,25
⇒ 4a = 0,25 ⇒ a = 0,0625 mol
![]() = 19,6
= 19,6
M(Be) = 9 < 19,6 < MB
19,6 = ![]() = 30,2 (loại)
= 30,2 (loại)
TH2: Vậy dung dịch sau phản ứng có HCl dư
![]()
⇒ nHCl(bđ) = 0,25 = 4a + a = 5a
⇒ a = 0,05
![]() = 24,5
= 24,5
Nếu A là Be ⇒ MA = 9
24,5 = ![]() = 40 (Ca)
= 40 (Ca)
Vậy 2 kim loại là Be và Ca

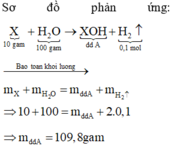
\(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
VH2O = 100ml => mH2O = 100g ( do d = 1g/ml)
Áp dụng ĐLBTKL:
\(m_A=10+100-0,1.2=109,8\left(g\right)\)
Phải có thêm dữ kiện mới xác định được 2 KL nhé
Bổ sung cho dễ làm: "2 kim loại kiềm ở 2 chu kì liên tiếp"
Tiếp tục với bài của bạn Phạm Vũ Trí Dũng
Gọi công thức chung của 2 kim loại là R
PTHH: \(R+H_2O\rightarrow ROH+\dfrac{1}{2}H_2\uparrow\)
Theo PTHH: \(n_R=2n_{H_2}=0,2mol\) \(\Rightarrow\overline{M}_R=\dfrac{10}{0,2}=50\)
Vì \(39< \overline{M}_R< 85,5\) \(\Rightarrow\) Kim loại cần tìm là Rb và K

Bài 31:
Gọi CT chung của 2 kim loại nhóm IIA (kim loại X,Y) cần tìm là Z. (M(X)<M(Z)<M(Y))
Ta có: Z +2 HCl -> ZnCl2 + H2
nH2=0,672/22,4=0,03=nZ
=> 24<M(Z)=mZ/nZ= 1,67/0,03=35,667<40
=> M(Mg) < M(Z) < M(Ca)
=> X là Magie (Mg), Y là Canxi (Ca)
=> CHỌN B
Bài 33:
nH2=0,1(mol) => mH2=0,1.2=0,2(g)
Đặt CTHH chung của 2 kim loại kiềm là A.
PTHH: A + H2O -> AOH + 1/2 H2
nH2O=nH2.2=0,1.2=0,2(mol) => mH2O=3,6(g)
Theo ĐLBTKL ta có:
mA+ mH2O = mAOH + mH2
<=>mAOH=(mA+mH2O) - mH2= 6,2 + 3,6 - 0,2= 9,6(g)
=> m(rắn)=9,6(g)
=> CHỌN C

\(n_{H_2}=\dfrac{1.12}{22.4}=0.05\left(mol\right)\)
\(2A+2nH_2O\rightarrow2A\left(OH\right)_n+nH_2\)
\(\dfrac{0.1}{n}........................0.05\)
\(M_A=\dfrac{3.9}{\dfrac{0.1}{n}}=39n\)
Với : \(n=1\rightarrow A=39\)
\(A:K\)
\(m_{KOH}=0.1\cdot56=5.6\left(g\right)\)
\(m_{ddX}=3.9+46.2-0.05\cdot2=50\left(g\right)\)
\(C\%_{KOH}=\dfrac{5.6}{50}\cdot100\%=11.2\%\)
\(b.\)
\(K_2O+H_2O\rightarrow2KOH\)
\(0.1....................0.2\)
\(m_{KOH}=0.2\cdot56=11.2\left(g\right)\)
\(m_{dd_X}=\dfrac{11.2}{28\%\%}=40\left(g\right)\)

Hoà tan hoàn toàn 6,2g hai kim loại kiềm ở 2 chu kì liên tiếp vào nước thu được H2 (đktc) và dung dịch X. Trung hòa ½ dung dịch X cần 100 ml dung dịch HCl 1M. Hai kim loại là
A. Li và Na B. Na và K C. K và Rb D. Rb và Cs
Gọi 2 kim loại cần tìm là R
\(R+H_2O\rightarrow ROH+\dfrac{1}{2}H_2\)
\(ROH+HCl\rightarrow RCl+H_2O\)
Số mol của 1/2 dung dịch X : \(n_{ROH}=n_{HCl}=0,1\left(mol\right)\)
\(n_{R\left(bđ\right)}=n_{ROH}=0,2\left(mol\right)\)
=> \(M_R=\dfrac{6,2}{0,2}=31\)
Vì hai kim loại kiềm ở 2 chu kì liên tiếp
=> 2 kim loại cần tìm là Na và K
=> Chọn B

$m_{H_2O} = D.V = 1.4,459 = 4,459(gam)$
Gọi $n_X = a(mol)$
$2X + 2H_2O \to 2XOH + H_2$
Theo PTHH : $n_{H_2} = \dfrac{1}{2}n_X = 0,5a(mol)$
$n_{XOH} = n_X = a(mol)$
Sau phản ứng, $m_{dd} = 0,897 + 4,459 - 0,5a.2 = 5,356 - a(gam)$
Suy ra :
$C\%_{XOH} = \dfrac{a(X + 17)}{5,356 - a}.100\% = 29,34\%$
mà $X.a = 0,897$ nên $a = 0,039 ; X = 23(Natri)$