Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta thấy 1,75 lít > 1 lít
Chứng tỏ phần tác dụng với nước thì n Na = n NaOH không tác dụng hết n Al, còn phần sau là mới tác dụng hết
Na + H2O --> NaOH + 1/2.H2
x ---- ------ --------> x -----> x/2
Al + NaOH + H2O --> NaAlO2 + 3/2.H2
x <-----x ------------ ------- ------- ------- -> 3x/2
=> x/2 + 3x/2 = 1 <=> x = 0.5
Ta tính số mol do Al sinh ra là = 1.75 - 0.5/2 = 1,5 mol
Al + NaOH + H2O --> NaAlO2 + 3/2.H2
1 <---------- --------- ---------- ----------- 1,5 mol
% m Al = ( 1.27 ) / (1.27 + 0.5.23 ) x 100% = 70,13%
=> %Na = 29,87%
=> Đáp án B

Đáp án A
Vì thể tích H2 sinh ra khi cho X tác dụng với H2O < thể tích khí H2 sinh ra khi cho X tác dụng với KOH dư.
⇒ Khi X tác dụng với H2O Al vẫn còn dư.
Đặt số mol Al = a và nNa = b.
+ Pứ với H2O Al còn dư ⇒ nAl pứ = nNa = b.
⇒ Bảo toàn e: 3b + b = 0,2×2 = 0,4 (1).
+ Pứ với KOH dư ⇒ Tan hoàn toàn.
⇒ Bảo toàn e: 3a + b = 0,35×2 = 0,7 (2).
+ Giải hệ (1) và (2) ⇒ nAl = 0,2 và nNa = 0,1.
⇒ mX = 0,2×27 + 0,1×23 = 7,7 gam

Đáp án B
Giả sử số mol Al là x thì số mol Na là 1,25x.
Cho X tác dụng với H2O thì số mol H2 thu được là 2,125x mol.
Z tác dụng với H2SO4 loãng thu được 0,25V lít khí tức 0,53125x mol
→ % F e = 56 . 0 , 53125 x 27 x + 1 , 25 x . 23 + 0 , 53125 x . 56 = 34 , 795 %

Đáp án : D
Na + H2O -> NaOH + 1 2 H2
NaOH + Al + H2O -> NaAlO2 + 3 2 H2
Vì nNa > nAl => chất rắn chỉ còn Fe
⇒ n F e = n H 2 s a u = 0 , 25 V 22 , 4 ( m o l )
⇒ n H 2 = 1 2 n N a + 3 2 n A l = V 22 , 4
Mà nAl : nNa = 4 : 5
=> nAl = 8V/(17.22,4) ; nNa = 10V/(17.22,4)
=> %mFe = 34,80%

Đáp án B
Rắn X phải có A1 dư vì chỉ có A1 mới phản ứng với dung dịch NaOH tạo khí H2. Mặt khác do phản ứng hoàn toàn nên Fe3O4 hết.
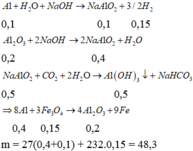

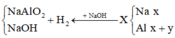
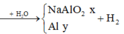


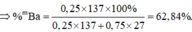


Đáp án D
Do các khí đo ở cùng điều kiện nên ta “có thể” coi V như số mol để tính cho đơn giản.
TH1:
TH2: