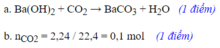Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1.1. Al + NaOH + H2O ==> NaAlO2 + 3/2H2
nH2(1)=3,36/22,4=0.15(mol)
=> nAl(1)= nH2(1):3/2= 0.15:3/2= 0.1(mol)
2.Mg + 2HCl ==> MgCl2 + H2
3.2Al + 6HCl ==> 2AlCl3 + 3H2
4.Fe + 2HCl ==> FeCl2 + H2
=> \(n_{H_2\left(2,3,4\right)}=\) 10.08/22.4= 0.45(mol)
=> nH2(3)=0.1*3/2=0.15(mol)
MgCl2 + 2NaOH ==> Mg(OH)2 + 2NaCl
AlCl3 + 3NaOH ==> Al(OH)3 + 3NaCl
FeCl2 + 2NaOH ==> Fe(OH)2 + 2NaCl

\(n_{hh}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
Do SO2 và O2 tỉ lệ mol 1:1
=> \(n_{SO_2}=n_{O_2}=0,2\left(mol\right)\)
\(2SO_2+O_2-^{t^o,V_2O_5}\rightarrow2SO_3\)
Lập tỉ lệ : \(\dfrac{0,2}{2}< \dfrac{0,2}{1}\) => Sau phản ứng O2 dư, tính theo số mol của SO2
Theo PT: \(n_{SO_3}=n_{SO_2}=0,2\left(mol\right)\)
Hỗn hợp khí Y gồm SO3, O2
\(SO_3+Ba\left(OH\right)_2\rightarrow BaSO_4\)
\(n_{BaSO_4}=n_{SO_3}=0,2\left(mol\right)\)
\(\Rightarrow m_{BaSO_{\text{4 }}\left(lt\right)}=0,2.233=46,6\left(g\right)\)
Thực tế chỉ thu được 45,8g kết tủa
\(\Rightarrow H=\dfrac{45,8}{46,6}=98,28\%\)

a. PTHH:
Fe + 2HCl ---> FeCl2 + H2 (1)
Ta có: \(n_{Fe}=\dfrac{2,8}{56}=0,05\left(mol\right)\)
\(n_{HCl}=\dfrac{150}{1000}.2=0,3\left(mol\right)\)
Ta thấy: \(\dfrac{0,05}{1}< \dfrac{0,3}{2}\)
Vậy HCl dư.
Vậy trong X chứa FeCl2 và HCl dư.
b. PTHH:
2NaOH + FeCl2 ---> Fe(OH)2 + 2NaCl (2)
HCl + NaOH ---> NaCl + H2O (3)
Theo PT(1): \(n_{H_2}=n_{Fe}=0,05\left(mol\right)\)
=> \(V_{H_2}=0,05.22,4=1,12\left(lít\right)\)
c. Theo PT(1): \(n_{FeCl_2}=n_{Fe}=0,05\left(mol\right)\)
Theo PT(2): \(n_{Fe\left(OH\right)_2}=n_{FeCl_2}=0,05\left(mol\right)\)
=> \(m_{Fe\left(OH\right)_2}=0,05.90=4,5\left(g\right)\)

Dung dịch X có thể td được vừa hết với 0,08 mol NaOH hoặc 0,1 mol HCl
Suy ra Na2CO3 phải còn dư vì nếu Na2CO3 hết thì tỷ lệ NaOH và HCl phải bằng nhau
Na2CO3 + Ba(HCO3)2 --> 2NaHCO3 + BaCO3 (1)
x mol----------x----------------------2x--...
n (Na2CO3 dư) = y mol
CaCO3: zmol
dd X: NaHCO3 2x mol; Na2CO3 ymol
NaHCO3 + NaOH --> Na2CO3 + H2O (2)
---> 2x = 0,08 mol
--> x = 0,04 mol
NaHCO3 + HCl --> NaCl + H2O + CO2 (3)
2x mol-------2x
Na2CO3 + 2HCl ---> 2NaCl + H2O + CO2 (4)
y mol-------2y
từ pt 3 4 suy ra 2y = 0,02
--> y - 0,01 mol
Nên Na2CO3 ban đầu 0,05 mol
rắn Y CaCO3 zmol và BaCO3 x mol
CaCO3 + 2 HCl ---> CO2 + CaCl2 + H2O (5)
z mol----------------------z
BaCO3 + 2 HCl ---> CO2 + BaCl2 + H2O (6)
x mol----------------------x
n (CO2) = x + z mol
Ca(OH) + CO2 --> CaCO3 + H2O (7)
---> x + z = 0,16 mol
---> z = 0,12 mol
Tóm lại trong A có
Na2CO3 0,05 mol
CaCO3 0,12 mol
bạn tự làm tiếp nhé
Chúc bạn học tốt!

a)
4FeCO3 + O2 --> 2Fe2O3 + 4CO2 (1)
4FexOy + (3x-2y)O2 --> 2xFe2O3 (2)
CO2 + Ba(OH)2 → BaCO3 + H2O (3)
2CO2 + Ba(OH)2 → Ba(HCO3)2 (4)
b)
Giả sử Ba(OH)2 dư , chỉ xảy ra (3) không xảy ra pư (4)
nBaCO3 = 0,02 mol = nCO2
=> nFe2O3 (1) = 0,01 mol
Mà \(\Sigma\)nFe2O3 (1) + (2) = \(\dfrac{11,2}{160}\)= 0,07 mol => nFe2O3 (2) = 0,07 -0,01 = 0,06 mol
=> nFexOy = \(\dfrac{0,12}{x}\) mol
mFexOy = 12,64 - mFeCO3 = 12,64 - 0,02.116 = 10,32 gam
=> M FexOy = 86x (g/mol)
Với x = 1,2,3 ... đều không thỏa mãn
=> Ba(OH)2 phản ứng hết, xảy ra cả phản ứng (3) và (4)
nBa(OH)2 = 0,03 mol , nBaCO3 = 0,02 mol
=> nBa(OH)2 (4) = 0,03 - 0,02 = 0,01 mol
=> nCO2 (4) = 0,01.2 = 0,02 mol
=> nCO2 (1) = nCO2 (3) + nCO2 (4) = 0,04 mol
<=> nFe2O3 (1) = 0,02 mol , nFeCO3 = 0,04 mol
=> nFe2O3 (2) = 0,07 - 0,02 = 0,05 mol <=> n FexOy = \(\dfrac{0,1}{x}\) mol
mFexOy = 12,64 - mFeCO3 = 12,64 - 0,04.116 = 8 gam
=> M FexOy = 80x (g/mol)
với x = 2 => mFexOy = 160 (g/mol) <=> Fe2O3