Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Ta có: nHCl = 0,036 mol, nHNO3 = 0,036 mol, nH2SO4 = 0,024 mol
⇒ ∑nH+ = 0,12 mol || ∑nOH– = 0,08×2×V + 0,23×V = 0,39V.
+ Vì pH = 2 ⇒ Sau pứ trung hòa nH+ dư = 102×(0,36+V) = 0,01V + 0,0036
+ Ta có: ∑nH+ = ∑nOH– + nH+ dư ⇔ 0,12 = 0,39V + 0,01V + 0,0036.
Û V = 0,291 lít ⇒ nBa(OH)2 = 0,02328 mol.
+ Vì nBa2+ < nSO42– ⇒ m↓ = mBaSO4 = 0,02328×233 ≈ 5,42 gam

\(n_{Ba^{2+}}=0.1\cdot0.05=0.005\left(mol\right)\)
\(n_{OH^-}=0.1\cdot0.05\cdot2+0.1\cdot0.3=0.04\left(mol\right)\)
\(n_{Fe^{2+}}=0.1\cdot0.2=0.02\left(mol\right)\)
\(n_{SO_4^{2-}}=0.1\cdot0.1=0.01\left(mol\right)\)
\(n_{H^+}=0.1\cdot0.1\cdot2=0.02\left(mol\right)\)
\(Ba^{2+}+SO_4^{2-}\rightarrow BaSO_4\)
\(0.005....0.005..........0.005\)
\(\Rightarrow SO_4^{2-}dư\)
\(OH^-+H^+\rightarrow H_2O\)
\(0.02.......0.02\)
\(Fe^{2+}+2OH^-\rightarrow Fe\left(OH\right)_2\)
\(0.01....0.04-0.02....0.01\)
\(\Rightarrow Fe^{2+}dư\)
\(m\downarrow=0.005\cdot197+0.01\cdot90=2.065\left(g\right)\)

Đáp án D
VX = 0,3 lit
=> Thể tích mỗi dung dịch axit thành phần là 0,1 lit
=> nH+ = nHCl + 2nH2SO4 + 3nH3PO4 = 0,1.0,3 + 2.0,1.0,2 + 3.0,1.0,1 = 0,1 mol
Để trung hòa thì : nH+ = nOH- = 0,1 mol
Có : nOH- = nNaOH + 2nBa(OH)2 = (0,2 + 0,1.2).V.10-3 = 0,1 mol
=> V = 250 ml

Đáp án C
nH+ = 0,02 mol; nOH-= 0,04 mol
H+ + OH- → H2O
0,02 0,04
nOH- dư = 0,02 mol; [OH-] dư = 0,02/0,2 = 0,1M suy ra [H+] = 10-13 M suy ra pH = 13

Đáp án A
∑ nH+ = 2nH2SO4 + nHCl = 2. 0,1.0,05 + 0,1.0,1 = 0,02 (mol)
∑ nOH- = nNaOH + 2nBa(OH)2 = 0,1.0,2 + 2. 0,1.0,1 = 0,04 (mol)
H+ + OH- → H2O
0,02 → 0,02
=> nOH- dư = 0,04 – 0,02 = 0,02 (mol)
=> [OH-] = n: V = 0,02 : 0,2 = 0,01 M
pH = 14 + log(OH-) = 14 + (-1) = 13
Chú ý:
pH được tính theo giá trị của log[H+] chứ không phải log [OH-]

Đáp án A
nH+= nHCl+ 2nH2SO4+ 3nH3PO4= 0,1.0,3+ 2.0,2.0,1+ 3.0,1.0,1=0,1 mol
nOH-= (V.0,1+2.0,2.V)/1000 mol
H+ + OH-→ H2O
Theo PT: nH+= nOH- nên 0,1=(V.0,1+2.0,2.V)/1000 suy ra V= 200 ml
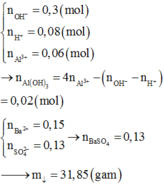
Đáp án B
nNaOH = 0,2 mol ; nBa(OH)2 = 0,05 mol; nOH-= 0,3 mol
nAl2(SO4)3 = 0,04 mol; nH2SO4 = 0,1.x mol; nH+ = 0,2x mol
H++ OH-→ H2O
0,2x 0,2x mol
Ba2+ + SO42- → BaSO4
0,05 0,12 0,05
Suy ra nAl(OH)3 = 0,06 mol < nAl3+ nên có 2 trường hợp xảy ra:
TH1: Kết tủa không bị hòa tan
Al3++ 3OH- → Al(OH)3
0,08 0,18← 0,06 mol
nOH- tổng = 0,22x+ 0,18 = 0,3 suy ra x = 0,6M
TH2: Kết tủa bị hòa tan 1 phần
Al3++ 3OH- → Al(OH)3
0,08 0,24 0,08
Al(OH)3+ OH- → AlO2-+ 2H2O
0,02 0,02
nOH- tổng = 0,2x+ 0,24+ 0,02 = 0,3 suy ra x = 0,2M