Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)2NaOH+H2SO4→Na2SO4+2H2O(1)
Cu(NO3)2+2NaOH→Cu(OH)2+2NaNO3(2)
Cu(OH)2→CuO+H2O(3)
nCuO=\(\dfrac{1,6}{80}\)=0,02mol
mddNaOH=31,25×1,12=35g
nNaOH=35×16%40=0,14mol
nNaOH(2)=0,02×2=0,04mol
⇒nNaOH(1)=0,14−0,04=0,1mol
nH2SO4=0,12=0,05mol
CM(H2SO4)=\(\dfrac{0,05}{0,05}\)=1M
CM(Cu(NO3)2)=\(\dfrac{0,02}{0,05}\)=0,4M
b)nCu=\(\dfrac{2,4}{64}\)=0,0375mol
nH+=2nH2SO4=0,1mol
nNO3−=2nCu(NO3)2=0,04mol
Cu+4H++NO3−→Cu2++NO+2H2O
\(\dfrac{0,04}{1}\)>\(\dfrac{0,03751}{1}\)>\(\dfrac{0,1}{4}\)⇒ Tính theo ion H+nNO=0,14=0,025mol
⇒VNO=0,025×22,4=0,56l

mdd NaOH = 62,5.1,12 = 70 (g)
=> \(n_{NaOH}=\dfrac{70.16\%}{40}=0,28\left(mol\right)\)
Gọi \(\left\{{}\begin{matrix}C_{M\left(H_2SO_4\right)}=aM\\C_{M\left(Cu\left(NO_3\right)_2\right)}=bM\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}n_{H_2SO_4}=0,1a\left(mol\right)\\n_{Cu\left(NO_3\right)_2}=0,1b\left(mol\right)\end{matrix}\right.\)
PTHH: 2NaOH + H2SO4 --> Na2SO4 + 2H2O
0,2a<----0,1a
2NaOH + Cu(NO3)2 --> Cu(OH)2 + 2NaNO3
0,2b<-----0,1b--------->0,1b
Cu(OH)2 --to--> CuO + H2O
0,1b------------>0,1b
=> \(0,1b=\dfrac{1,6}{80}=0,02\)
=> b = 0,2
Có: nNaOH = 0,2a + 0,2b = 0,28
=> a = 1,2
Vậy \(\left\{{}\begin{matrix}C_{M\left(H_2SO_4\right)}=1,2M\\C_{M\left(Cu\left(NO_3\right)_2\right)}=0,2M\end{matrix}\right.\)


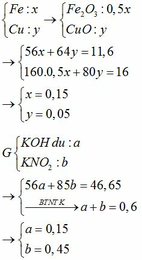
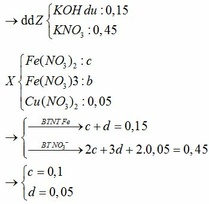

BTKL
mX + mdd HNO3 = mdd X + mH2O + m↑
=> mdd X = 11,6 + 87,5 – 30 . 0,1 – 46 . 0,15 = 89,2g
=> C%Fe(NO3)3 = 13,565%

Pt:
Fe3O4 + 4H2SO4 → FeSO4 + Fe2(SO4)3 + 4H2O
0,1 → 0,4 0,1 0,1
Cu + Fe2(SO4)3 → CuSO4 + 2FeSO4
0,1 ←0,1 → 0,1 0,2
Rắn B là 0,1 mol Cu → x = 6,4 (g)
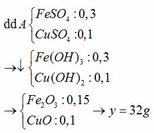

Phản ứng nung kết tủa chỉ thu đc một oxit. Vậy Al đẩy hết Ag và đẩy được Cu hoặc ko. Oxit đó là CuO.
\(\rightarrow n_{CuO}=n_{Cu\left(NO3\right)2_{du}}=0,03\left(mol\right)\)
\(n_{Al}=0,08\left(mol\right)\)
Gọi a là mol AgNO3.
- Giả sử Al đẩy vừa đủ Ag, ko đẩy Cu. Khi đó A gồm Ag
\(Al+3AgNO_3\rightarrow Al\left(NO_3\right)_3+3Ag\)
\(\rightarrow n_{Ag}=0,24\left(mol\right)\rightarrow m_{Ag}=25,92\left(g\right)\) (loại)
- Giả sử Al đẩy hết Ag; đẩy một phần Cu.
\(Al+3AgNO_3\rightarrow Al\left(NO_3\right)_3+3Ag\)
\(\rightarrow n_{Ag}=n_{AgNO3}=a\left(mol\right);n_{Al_{pu}}=\frac{a}{3}\left(mol\right)\)
\(n_{Al.day.Cu}=0,08-\frac{a}{3}=\frac{0,24-a}{3}\)
\(2Al+3Cu\left(NO_3\right)_2\rightarrow2Al\left(NO_3\right)_3+3Cu\)
\(\rightarrow n_{Cu}=\frac{0,24-a}{3}\left(mol\right)\) = nCu(NO3)2 phản ứng
\(m_A=12,24\rightarrow108a+32\left(0,24-a\right)=12,24\)
\(\Leftrightarrow a=0,06\)
\(\rightarrow n_{AgNO3}=0,06\left(mol\right);n_{Cu\left(NO3\right)2_{pu}}=0,09\left(mol\right)\)
\(\Rightarrow n_{Cu\left(NO3\right)2_{ban.dau}}=0,09+0,03=0,12\left(mol\right)\)
\(CM_{AgNO3}=\frac{0,06}{0,2}=0,3M\)
\(CM_{Cu\left(NO3\right)2}=\frac{0,12}{0,2}=0,6M\)

a)
$FeCl_3 + 3NaOH \to Fe(OH)_3 + 3NaCl$
$2Fe(OH)_3 \xrightarrow{t^o} Fe_2O_3 + 3H_2O$
$n_{FeCl_3} = 0,3.2 = 0,6(mol)$
Theo PTHH : $n_{Fe_2O_3} = \dfrac{1}{2}n_{FeCl_3} = 0,3(mol)$
$\Rightarrow m_{Fe_2O_3} = 0,3.160 = 48(gam)$
b) Sau phản ứng, $V_{dd} = 0,3 + 0,3 = 0,6(lít)$
$n_{NaCl} = 3n_{FeCl_3} = 1,8(mol) \Rightarrow C_{M_{NaCl}} = \dfrac{1,8}{0,6} = 3M$

M + 2HCl → MCl2 + H2↑
MO + 2HCl → MCl2 + H2O
MCl2 + 2NaOH → M(OH)2↓ + 2NaCl
M(OH)2 → MO + H2O
M + CuCl2 → MCl2 + Cu↓