Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{HCl}=0,12.2=0,24\left(mol\right)\)
=> \(n_{H_2O}=0,12\left(mol\right)\)
=> \(n_{O\left(oxit\right)}=0,12\left(mol\right)\)
=> \(n_{O_2}=0,06\left(mol\right)\)
\(n_{Mg}=\dfrac{1,68}{24}=0,07\left(mol\right)\); \(n_{Al}=\dfrac{2,16}{27}=0,08\left(mol\right)\)
Gọi số mol Cl2 là x (mol)
Mg0 - 2e --> Mg+2
0,07->0,14
Al0 - 3e --> Al+3
0,08->0,24
O20 + 4e --> 2O-2
0,06->0,24
Cl20 + 2e --> 2Cl-
x--->2x
Bảo toàn e: 2x + 0,24 = 0,24 + 0,14
=> x = 0,07 (mol)
=> \(\%V_{Cl_2}=\dfrac{0,07}{0,06+0,07}.100\%=53,846\%\)

Đặt \(\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\\n_{Zn}=c\left(mol\right)\\n_{Al}=d\left(mol\right)\end{matrix}\right.\) \(\Rightarrow95a+127b+136c+133,5d=40,45\) (1)
Sau p/ứ với Clo, ta được: \(95a+162,5b+136c+133,5d=44\) (2)
Lấy PT (2) trừ PT (1) \(\Rightarrow35,5b=3,55\) \(\Rightarrow b=n_{Fe}=0,1\left(mol\right)\)
\(\Rightarrow\%m_{Fe}=\dfrac{0,1\cdot56}{13,47}\cdot100\%\approx41,57\%\)

Gọi \(n_{Mg} = a(mol) ; n_{Al} = b(mol)\\ \Rightarrow 24a + 27b = 5,7(1)\)
\(Mg^0 \to Mg^{+2} + 2e\\ Al^0 \to Al^{+3} + 3e\\ O_2 + 4e \to 2O^{-2}\\ Cl_2 + 2e \to 2Cl^-\)
Bảo toàn electron : \(2n_{Mg} + 3n_{Al} = 2a + 3b = 4n_{O_2} + 2n_{Cl_2} = 1,2(mol)\)(2)
Từ (1)(2) suy ra : a = -0,85< 0 ⇒ Sai đề
X{Mg, Al} + {Cl2, O2} → Z
Áp dụng định luật BTKL: mCl2 + mO2 = mZ – mX = 19,7 – 7,8 = 11,9 gam
Theo đề bài ta có hệ phương trình:
⎧⎪⎨⎪⎩nCl2+nO2=5,622,4=0,2571nCl2+32nO2=11,9→{nCl2=0,1nO2=0,15{nCl2+nO2=5,622,4=0,2571nCl2+32nO2=11,9→{nCl2=0,1nO2=0,15
Đặt số mol của Mg và Al lần lượt là x và y (mol)
- Khối lượng hỗn hợp: 24x + 27y = 7,8 (1)
- Bảo toàn e: 2nMg + 3nAl = 2nCl2 + 4nO2 => 2x + 3y = 0,1.2 + 0,15.4 hay 2x + 3y = 0,8 (2)
Giải (1) và (2) thu được x = 0,1 và y = 0,2
=> %mAl = 0,2.27/7,8 = 69,23%
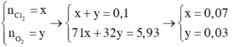
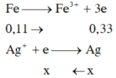
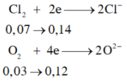

\(n_{H^+} = n_{HCl} = 0,12.2 = 0,24(mol)\\ 2H^+ + O^{2-} \to H_2O\\ n_{O(oxit)} = \dfrac{1}{2}n_{H^+} = 0,12(mol)\\ \Rightarrow n_{O_2} = \dfrac{n_{O(oxit)}}{2} = 0,06(mol)\\ n_{Mg} = \dfrac{1,68}{24} = 0,07(mol) ; n_{Al} = \dfrac{2,16}{27} = 0,08(mol)\)
Bảo toàn electron :
\(2n_{Mg} + 3n_{Al} = 4n_{O_2} + 2n_{Cl_2}\\ \Rightarrow n_{Cl_2} = \dfrac{0,07.2 + 0,08.3-0,06.4}{2} = 0,07(mol)\\ \Rightarrow \%V_{Cl_2} = \dfrac{0,07}{0,07+0,06}.100\% = 53,85\%\)
Đề bài có thiếu dữ kiện k e