Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{NaOH}=2.0,03=0,06\left(mol\right)\)
\(n_{Ca\left(OH\right)2}=2.0,02=0,04\left(mol\right)\)
\(n_{CaCO3}=\dfrac{3}{100}=0,03\left(mol\right)\)
Thứ tự các pthh :
\(C+O_2-t^o->CO_2\) (1)
\(CO_2+Ca\left(OH\right)_2-->CaCO_3+H_2O\) (2)
\(CO_2+2NaOH-->Na_2CO_3+H_2O\) (3)
\(CO_2+Na_2CO_3-->2NaHCO_3\) (4)
\(CO_2+CaCO_3-->Ca\left(HCO_3\right)_2\) (5)
Vì \(n_{CaCO3}< n_{Ca\left(OH\right)2}\left(0,03< 0,04\right)\) => Có 2 giá trị của CO2 thỏa mãn
TH1: CO2 thiếu ở pứ 2 => Chỉ xảy ra pứ (1) và (2) => Không có pứ hòa tan kết tủa
Theo pthh (2) : \(n_{CO_2}=n_{CaCO3}=0,03\left(mol\right)\)
Bảo toản C : \(n_C=n_{CO2}=0,03\left(mol\right)\)
=> m = 0,03.12 = 0,36 (g)
TH2 : CO2 dư ở pứ (2) ; (3); (4), đến pứ (5) thì thiếu => Có pứ hòa tan kết tủa
Xét pứ (2); (3); (4) ; (5) :
\(\Sigma n_{CO2}=n_{Ca\left(OH\right)2}+\dfrac{1}{2}n_{NaOH}+n_{Na2CO3}+n_{CaCO3\left(tan\right)}\)
\(=n_{Ca\left(OH\right)2}+\dfrac{1}{2}n_{NaOH}+\dfrac{1}{2}n_{NaOH}+\left(n_{CaCO3\left(sinh.ra\right)}-n_{CaCO3thu.duoc}\right)\)
\(=n_{Ca\left(OH\right)2}+n_{NaOH}+\left(n_{Ca\left(OH\right)2}-0,03\right)\)
\(=2n_{Ca\left(OH\right)2}+n_{NaOH}-0,03\)
\(=2.0,04+0,06-0,03\)
\(=0,09\left(mol\right)\)
Bảo toàn C : \(n_C=n_{CO2}=0,09\left(mol\right)\)
\(\Rightarrow m=0,09.12=1,08\left(g\right)\)
Em làm đúng rồi đấy nhưng TH 2 bước cuối chắc tính nhầm kìa nCO2 = 0,11 mol , e sửa lại nhé.

MX = 48 → nX = 0,96/48 = 0,02
Ta có:
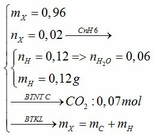
CO2 + Ba(OH)2 → BaCO3 + H2O
0,05 ←0,05 → 0,05
CO2 + BaCO3 + H2O → Ba(HCO3)2
0,02→ 0,02
Dư: 0,03
→ nBaCO3 dư = 0,03 → x = 5,91 (g) và mdd giảm = mBaCO3 – mCO2 + mH2O= 1,75 (g)

a) Gọi số mol Na2CO3, NaHCO3 là a, b (mol)
Có \(\dfrac{m_{Na_2CO_3}}{m_{NaHCO_3}}=\dfrac{106a}{84b}=\dfrac{21,2\%}{42\%}\)
=> \(\dfrac{a}{b}=\dfrac{2}{5}\)
Bảo toàn C: nCO2 = a + b = 3,5a (mol)
mdd sau pư = 69,2 + 154a (g)
=> \(C\%_{Na_2CO_3}=\dfrac{106a}{69,2+154a}.100\%=21,2\%\)
=> a = 0,2 (mol)
=> b = 0,5 (mol)
=> nC = 0,7 (mol)
\(n_{H_2O}=\dfrac{10,8}{18}=0,6\left(mol\right)\) => nH = 1,2 (mol)
\(\overline{M}_A=\dfrac{3,36}{\dfrac{2,688}{22,4}}=28\left(g/mol\right)\)
Mà MCO = 28 (g/mol)
=> MX = 28 (g/mol)
=> X là C2H4
Đặt \(\left\{{}\begin{matrix}n_{CO}=x\left(mol\right)\\n_{C_2H_4}=y\left(mol\right)\end{matrix}\right.\)
Bảo toàn C: x + 2y = 0,7
Và x + y = \(\dfrac{8,96}{22,4}=0,4\)
=> x = 0,1 (mol); y = 0,3 (mol)
=> \(\left\{{}\begin{matrix}\%V_{CO}=\dfrac{0,1}{0,4}.100\%=25\%\\\%V_{C_2H_4}=\dfrac{0,3}{0,4}.100\%=75\%\end{matrix}\right.\)
b)
Xét tỉ lệ T = \(\dfrac{n_{KOH}}{n_{CO_2}}=\dfrac{n_{KOH}}{0,7}\)
Pư tạo ra 2 muối khi 1 < T < 2
<=> \(1< \dfrac{n_{KOH}}{0,7}< 2\)
<=> 0,7 < nKOH < 1,4
Vậy \(0,875\left(l\right)< V_{dd}< 1,75\left(l\right)\)
n H2O=0,1 mol
-> V H2O=2,24 lít
2CO + O2-to->2CO2
a-> 0,5a-> a lít
CxHy + (x+y/4)O2-to->xCO2+y/2H2O
b-> b(x+y/4)-> bx -> 0,5by lít
a+b=6,72
0,5a +bx +by/4=7,84
a+bx =8,96
0,5by=2,24
giải pt
a=4,48
b=2,24
x=2
y=2
-> CT :C2H2
CH nối ba CH
%V CO=66,67%
%V C2H2=33,33%

Ta có: \(n_{K_2CO_3}=0,1.0,2=0,02\left(mol\right)\)
\(n_{KOH}=0,1.1,4=0,14\left(mol\right)\)
\(n_{BaCO_3}=\dfrac{11,82}{197}=0,06\left(mol\right)\)
TH1: KOH dư.
Giả sử: nCO2 = x (mol)
\(CO_2+2KOH\rightarrow K_2CO_3+H_2O\)
x_________________x (mol)
⇒ ΣnK2CO3 = x + 0,02 (mol)
\(K_2CO_3+BaCl_2\rightarrow2KCl+BaCO_3\)
x + 0,02___________________x + 0,02 (mol)
⇒ x + 0,02 = 0,06 ⇔ x = 0,04 (mol)
⇒ VCO2 = 0,04.22,4 = 0,896 (l)
TH2: KOH hết.
\(BaCl_2+K_2CO_3\rightarrow2KCl+BaCO_3\)
_________0,06_____________0,06 (mol)
⇒ nK2CO3 (do CO2 pư tạo thành) = 0,06 - 0,02 = 0,04 (mol)
\(CO_2+2KOH\rightarrow K_2CO_3+H_2O\)
0,04___0,08_______0,04 (mol)
\(CO_2+KOH\rightarrow KHCO_3\)
0,06__(0,14-0,08) (mol)
⇒ nCO2 = 0,04 + 0,06 = 0,1 (mol)
⇒ VCO2 = 0,1.22,4 = 2,24 (l)
Bạn tham khảo nhé!

a, \(C_2H_4+3O_2\underrightarrow{t^o}2CO_2+2H_2O\)
b, \(n_{C_2H_4}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
\(n_{CO_2}=2n_{C_2H_4}=0,4\left(mol\right)\Rightarrow m_{CO_2}=0,4.44=17,6\left(g\right)\)
c, \(CO_2+Ca\left(OH\right)_2\rightarrow CaCO_3+H_2O\)
\(n_{CaCO_3}=n_{CO_2}=0,4\left(mol\right)\Rightarrow m_{CaCO_3}=0,4.100=40\left(g\right)\)


Em cảm ơn ạ!!!