Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Trong trường hợp này, X đã “bão hòa”, không thể cho e được nữa, nhưng nó đã được CO lấy đi một lượng O để phá vỡ trạng thái này. CO + [O] →CO2
Và thế là X trở thành Y, lại có thể cho e với N+5 tạo thành NO, NO2.
Theo lý thuyết, nếu HNO3 lại đưa Y lên trạng thái bão hòa thì số mol e mà N+5 nhận được là 0,24 x 2 = 0,48 mol
Nhưng trên thực tế, con số này là 0,11 x 3 + 0,07 x 1= 0,40 mol
Sở dĩ điều này xảy ra là do có một lượng Fe chỉ tồn tại ở số oxi hóa +2
→ nFe2+ = 0,48 – 0,40 =0,08 → mFe(NO3)2 = 14,4 gam
Chọn đáp án C

Đáp án A
Quy hỗn hợp X chứa hai chất: FeO xmol và Fe2O3 y mol
Cho X+ khí CO→Chất rắn Y + khí Z chứa CO, CO2
CO2+ Ca(OH)2 → CaCO3+ H2O
Có: nCO2= nCaCO3= 0,04 mol
Cho Y + H2SO4 đặc nóng dư thu được nSO2=0,045 mol
- Quá trình cho e:
FeO → Fe3++ 1e
x x mol
C+2 → C+4+ 2e
0,04 0,08 mol
- Quá trình nhận electron:
S+6+ 2e → SO2
0,09← 0,045 mol
Theo định luật bảo toàn electron:
ne cho= ne nhận → x+0,08 = 0,09→ x= 0,01mol
Muối thu được sau phản ứng là Fe2(SO4)3
→ nFe2(SO4)3= 18/400= 0,045 mol
Bảo toàn nguyên tố Fe ta có:
x+ 2y= 0,045.2→ y= 0,04 mol
→ m= mFeO + mFe2O3=72x + 160y= 72.0,01+ 160.0,04= 7,12 gam
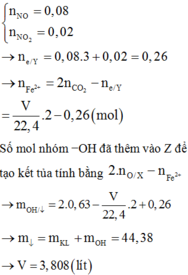

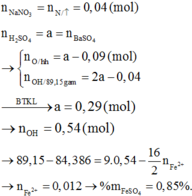




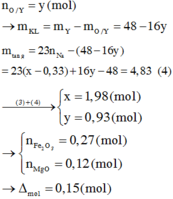
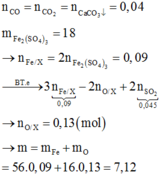

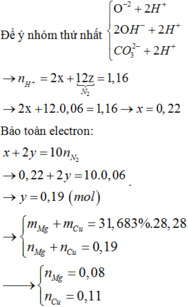

Chọn đáp án D