Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Vai trò của H2 là chất khử oxi
nPbO = 2,23/223 = 0,01 (mol)
nCuO = 3,2/80 = 0,04 (mol)
PTHH:
PbO + H2 -> (t°) Pb + H2O
0,01 ---> 0,01 ---> 0,01
CuO + H2 -> (t°) Cu + H2O
0,04 ---> 0,04 ---> 0,04
mPb = 0,01 . 217 = 2,17 (g)
mCu = 0,04 . 64 = 2,56 (g)
nH2 = 0,04 + 0,01 = 0,05 (mol)

Bài 11:
\(a,n_{Fe_2O_3}=\dfrac{1,6}{160}=0,01\left(mol\right)\\ n_{Cu}=\dfrac{4}{80}=0,05\left(mol\right)\\ PTHH:\\ Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
0,01 -----> 0,03 ---> 0,02
\(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
0,05 ---> 0,05 -> 0,05
\(b,m_{Fe}=0,02.56=1,12\left(g\right)\\ m_{Cu}=0,05.64=3,2\left(g\right)\\ V_{H_2}=\left(0,03+0,05\right).22,4=1,792\left(l\right)\)
Bài 12:
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\ n_{O\left(trong.oxit\right)}=n_{H_2}=0,15\left(mol\right)\\ n_{Fe\left(trong.oxit\right)}=\dfrac{8-0,15,16}{56}=0,1\left(mol\right)\\ CTHH:Fe_xO_y\\ \Rightarrow x:y=0,1:0,15=2:3\\ CTHH:Fe_2O_3\)

nPbO = 4,46 : 217 = 0,02 (mol)
pthh : PbO + H2 -t--> H2O + Pb
0,02 0,02 0,02
H2 dùng để khử O2
mPb = 0,02 . 201 = 4,02 (g)
VH2 = 0,02 . 22,4 = 0,448 ( L)
nPbO = 4,46 : 217 = 0,02 (mol)
pthh : PbO + H2 -t--> H2O + Pb
0,02 0,02 0,02
H2 dùng để khử PbO
mPb = 0,02 . 201 = 4,02 (g)
VH2 = 0,02 . 22,4 = 0,448 ( L)

nFe2O3 = 16,8/56 = 0,3 (mol)
PTHH: Fe2O3 + 3H2 -> (t°) 2Fe + 3H2O
MOL: 0,15 <--- 0,45 <--- 0,3
VH2 = 0,45 . 22,4 = 10,08 (l)
mFe2O3 = 0,45 . 160 = 72 (g)
a ) Fe2O3 + 3H2 ---> 2Fe + 3H2O
nFe = 16,8 :56 =0,3
Fe2O3 + 3H2--> 2Fe +3H2O
0,15<------0,45<---- 0,3
VH2 = 0,45.22,4=10,08(l)
mFe2O3 = 0,15.160 =24(g)

\(a) CuO + H_2 \xrightarrow{t^o} Cu + H_2O\\ Fe_2O_3 + 3H_2 \xrightarrow{t^o} 2Fe + 3H_2O\\ b) n_{CuO} = \dfrac{32.25\%}{80} = 0,1(mol)\\ n_{Fe_2O_3} = \dfrac{32-0,1.80}{160} = 0,15(mol)\\ n_{Cu} = n_{CuO} = 0,1(mol) \Rightarrow m_{Cu} = 0,1.64 = 6,4(gam)\\ n_{Fe} = 2n_{Fe_2O_3} = 0,3(mol) \Rightarrow m_{Fe} = 0,3.56 = 16,8(gam)\)

PTHH :
CuO + CO →→ Cu + CO2 (1)
Fe2O3 + 3CO →→ 2Fe + 3CO2 (2)
Fe + H2SO4→→ FeSO4 + H2 (3)
*Sau phản ứng thu đc chất rắn là các kim loại => các kim loại đó là Cu và Fe => hỗn hợp Y phản ứng hết
*Mà cho Cu và Fe tác dụng với dd H2SO4 (loãng) chỉ có Fe pứ => kim loại màu đỏ không tan là Cu có m = 3,2(g)
Có : nCu = m/M = 3.2/64 =0,05(mol)
Theo PT(1) => nCuO = nCu =0,05(mol)
=> mCuO = n .M = 0,05 x 80 =4(g)
=> mFe2O3 = 20 - 4 =16(g)
Do đó : %mCuO = (mCuO : mhỗn hợp Y).100% =4/20 . 100% =20%
=> %mFe2O3 = 100% - 20% = 80%
b) Khí sản phẩm đó là CO2
PTHH : CO2 + Ca(OH)2 →→ CaCO3 ↓↓ + H2O (4)
Theo PT(1) => nCO2 = nCuO = 0,05(mol)
Theo PT(2) => nCO2 = 3 . nFe2O3
mà nFe2O3 = m/M = 16/160 = 0,1(mol)
=> nCO2(PT2) = 3. 0,1 = 0,3(mol)
Do đó : tổng nCO2 = 0,05 + 0,3 = 0,35(mol)
Theo PT(4) => nCaCO3 = nCO2 = 0,35(mol)
=> mCaCO3(lý thuyết) = 0,35 . 100= 35(g)
mà hiệu suất chỉ đạt 80%
=> mCaCO3(thực tế) = 35 . 80% =28(g)
Vậy thu được 28g kết tủa

\(m_{Fe_2O_3}=16\cdot75\%=12\left(g\right)\)
\(n_{Fe_2O_3}=\dfrac{12}{160}=0.075\left(mol\right)\)
\(n_{CuO}=16\cdot25\%=4\left(g\right)\)
\(n_{CuO}=\dfrac{4}{80}=0.05\left(mol\right)\)
\(Fe_2O_3+3H_2\underrightarrow{^{^{t^0}}}2Fe+3H_2O\)
\(CuO+H_2\underrightarrow{^{^{t^0}}}Cu+H_2O\)
\(n_{H_2}=3\cdot0.075+0.05=0.275\left(mol\right)\)
a,\(m_{Fe_2O_3}=16.75\%=12\left(g\right)\Rightarrow n_{Fe_2O_3}=\dfrac{12}{160}=0,075\left(mol\right)\)
\(m_{CuO}=16-12=4\left(g\right)\Rightarrow n_{CuO}=\dfrac{4}{80}=0,05\left(mol\right)\)
PTHH: Fe2O3 + 3H2 → 2Fe + 3H2O
Mol: 0,075 0,225 0,15
PTHH: CuO + H2 → Cu + H2O
Mol: 0,05 0,05 0,05
\(\Rightarrow m_{Fe}=0,15.56=8,4\left(g\right);m_{Cu}=0,05.64=3,2\left(g\right)\)
b,\(n_{H_2}=0,225+0,05=0,275\left(mol\right)\)
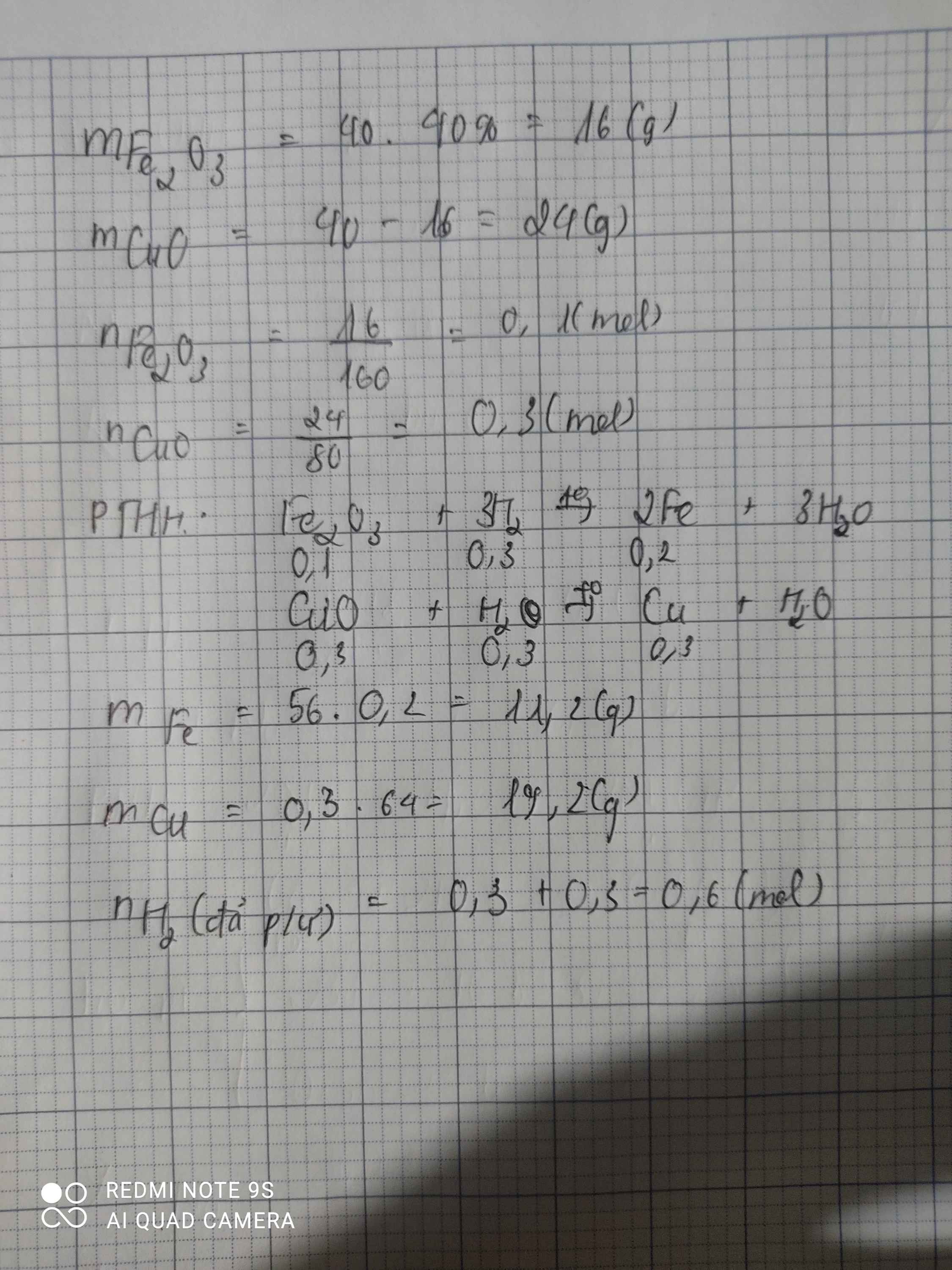
\(n_{Fe_2O_3}=\dfrac{3,2}{160}=0,02mol\)
\(n_{Cu}=\dfrac{8}{80}=0,1mol\)
\(Fe_2O_3+3H_2\rightarrow\left(t^o\right)2Fe+3H_2O\)
0,02 0,06 0,04 ( mol )
\(CuO+H_2\rightarrow\left(t^o\right)Cu+H_2O\)
0,1 0,1 0,1 ( mol )
\(m_{Fe}=0,04.56=2,24g\)
\(m_{Cu}=0,1.64=6,4g\)
\(n_{H_2}=0,06+0,1=0,16mol\)
\(n_{Fe_2O_3}=\dfrac{3,2}{160}=0,02mol\)
\(m_{CuO}=\dfrac{8}{80}=0,1mol\)
\(Fe_2O_3+3H_2\rightarrow2Fe+3H_2O\)
\(CuO+H_2\rightarrow Cu+H_2O\)
\(m_{Fe}=0,02\cdot2\cdot56=2,24g\)
\(m_{Cu}=0,1\cdot64=6,4g\)
\(\Sigma n_{H_2}=0,02\cdot3+0,1=0,16mol\Rightarrow V_{H_2}=3,584l\)