Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
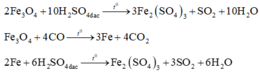
Coi oxit sắt ban đầu là hỗn hợp gồm Fe và O với nFe = a và nO = b.

Với lần thí nghiệm thứ nhất, có sự tham gia của O. Áp dụng định luật bảo toàn mol electron, ta có:
![]()
Với lần thí nghiệm thứ hai, không có sự tham gia của O. Áp dụng định luật bảo toàn mol
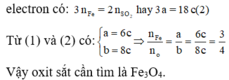

Đáp án C
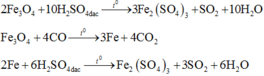
Coi oxit sắt ban đầu là hỗn hợp gồm Fe và O với nFe = a và nO = b.
Gọi thì ![]()
Các quá trình nhường và nhận electron diễn ra như sau:
Quá trình nhường electron:



Trong G dùng phương pháp đường chéo
ta được
NO2 ( amol) 13,42
30,58
N2O4 ( b mol) 2,58 ( thêm mũi tên chỉ xuống chỉ lên hộ)
Ta có:
a:b = 1:1 và a + b =0,06
=> a = b =0,03
Theo định luật bảo toàn electron
\(n_{enhận}=0,09\left(mol\right)\Rightarrow n_M=\dfrac{0,09}{n}\)
\(\Rightarrow M=18,67n\) khi n = 3
thì M là 56 ( M là Fe)
-Oxit sắt có chứa 27,59% oxi nên đó là Fe3O4
- cho Zn vào dd B , xảy ra pứ:
\(4Zn+NO^-_3+7OH^-\rightarrow4ZnO_4^-+NH_3+2H_2O\left(1\right)\)
Và : \(Zn+2OH^-\rightarrow ZnO^{2-}_2+H_2\left(2\right)\)
=> nZn = 0,37 (mol)
Theo định luật bảo toàn:
nNH3 = 0,09 => nZn (1)
= 0,36 (mol) ; nZn (2) = 0,01 (mol)
=> nH2 = 0,01 (mol) , VH2 = 2,24 (lít)

Gọi CTHH: Fe2Ox
a, Fe2Ox+ 2xHCl-->2 FeClx+ xH2O
Ta có nHCl=3.0,15=0,45 mol
b, mình nghĩ là bạn ghi sai đề, CO2 ko PỨ vs oxit sắt , chỉ có CO thôi nhé

\(n_{FeO}=\dfrac{0,36}{72}=0,005\left(mol\right)\)
\(n_{H_2SO_4}=2n_{FeO}=0,01\left(mol\right)\\ \Rightarrow m_{ddH_2SO_4}=\dfrac{0,01.98}{98\%}=1\left(g\right)\\ n_{Fe_2\left(SO_4\right)_3}=\dfrac{1}{2}n_{FeO}=0,0025\left(mol\right)\\ \Rightarrow m_{Fe_2\left(SO_4\right)_3}=0,0025.400=1\left(g\right)\)


PTHH :FexOy + 2yHCl ---> xFeCl2y/x + yH2O
FexOy + yCO => xFe + yCO2
Ta có
n HCl = 0,45 mol
n Fe = 0,15 mol
=> 0,45/2y = 0,15/x
=> x/y=2/3
CTPT Fe2O3