

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


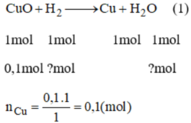
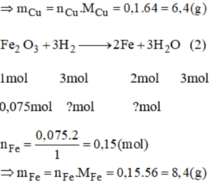

hỗn hợp 100% <=> 20g
1. fe2o3 60% <=> 12g <=> 0,075mol
cuo 40% <=> 8g <=> 0,1 mol
Ta có:
Fe2O3 + 3H2 --> 2Fe + 3H2O
mol: 0,075 0,225 0,15
CuO + H2 → Cu + H20
mol: 0.1 0.1 0.1
mFe= 0,15x56=8,4g. mCu=0,1x64= 6,4g
nH2= 0,225+0,1=0,325mol ==> V H2 = 0,325x 22,4 = 7,28 lít

Khối lượng Fe2O3 trong 20 gam hỗn hợp : \(20\cdot\dfrac{60}{100}=12\left(g\right)\)
\(\Rightarrow n_{Fe_2O_3}=\dfrac{m}{M}=\dfrac{12}{160}=0,075\left(mol\right)\)
Khối lượng CuO trong 20 gam hỗn hợp : \(\dfrac{20\cdot40}{100}=8\left(g\right)\)
\(\Rightarrow n_{CuO}=\dfrac{m}{M}=\dfrac{8}{80}=0,1\left(mol\right)\)
Phương trình phản ứng khử của H2 :
Fe2O3 + 3H2 \(\rightarrow\)2Fe + 3H2O
1---------3---------2
0,075-----0,225---0,15
Theo phương trình phản ứng trên , ta có : mFe = 0,15 . 56 = 8,4 ( g )
CuO + H2 \(\rightarrow\) Cu + H2O
1--------1------1
0,1------0,1-----0,1
Theo phương trình phản ứng trên : mCu = 0,1 . 64 = 6,4 ( gam )
a) Khối lượng Fe : 8,4 ( gam ) ; Khối lượng của Cu : 6,4 gam
b) Số mol H2 đã tham gia phản ứng : 0,225 + 0,1 = 0,325 ( mol )
\(m_{Fe_2O_3}=60\%.20=12\left(g\right)\)
\(n_{Fe_2O_3}=\dfrac{12}{160}=0,075\left(mol\right)\)
\(m_{CuO}=40\%.20=8\left(g\right)\)
\(n_{CuO}=\dfrac{8}{80}=0,1\left(mol\right)\)
Pt: \(Fe_2O_3+3H_2\rightarrow2Fe+3H_2O\)
0,075mol\(\rightarrow\)0,225mol\(\rightarrow\) 0,15mol
Pt: CuO + H2 \(\rightarrow\) Cu + H2O
0,1mol\(\rightarrow\)0,1mol\(\rightarrow\)0,1mol
a) \(m_{Fe}=0,15.56=8,4\left(g\right)\)
\(m_{Cu}=0,1.64=6,4\left(g\right)\)
b) \(n_{H_2\left(pư\right)}=0,225+0,1=0,325\left(mol\right)\)

\(m_{Fe_2O_3}=16\cdot75\%=12\left(g\right)\)
\(n_{Fe_2O_3}=\dfrac{12}{160}=0.075\left(mol\right)\)
\(n_{CuO}=16\cdot25\%=4\left(g\right)\)
\(n_{CuO}=\dfrac{4}{80}=0.05\left(mol\right)\)
\(Fe_2O_3+3H_2\underrightarrow{^{^{t^0}}}2Fe+3H_2O\)
\(CuO+H_2\underrightarrow{^{^{t^0}}}Cu+H_2O\)
\(n_{H_2}=3\cdot0.075+0.05=0.275\left(mol\right)\)
a,\(m_{Fe_2O_3}=16.75\%=12\left(g\right)\Rightarrow n_{Fe_2O_3}=\dfrac{12}{160}=0,075\left(mol\right)\)
\(m_{CuO}=16-12=4\left(g\right)\Rightarrow n_{CuO}=\dfrac{4}{80}=0,05\left(mol\right)\)
PTHH: Fe2O3 + 3H2 → 2Fe + 3H2O
Mol: 0,075 0,225 0,15
PTHH: CuO + H2 → Cu + H2O
Mol: 0,05 0,05 0,05
\(\Rightarrow m_{Fe}=0,15.56=8,4\left(g\right);m_{Cu}=0,05.64=3,2\left(g\right)\)
b,\(n_{H_2}=0,225+0,05=0,275\left(mol\right)\)

hỗn hợp 100% <=> 16g
1. fe2o3 75% <=> 12g <=> 0,075mol
cuo 25% <=> 4g <=> 0,1 mol
Ta có:
Fe2O3 + 3H2 --> 2Fe + 3H2O
mol: 0,075 0,225 0,15
CuO + H2 → Cu + H20
mol: 0.1 0.1 0.1
mFe= 0,15x56=8,4g. mCu=0,1x64= 6,4g
nH2= 0,225+0,1=0,325mol ==> V H2 = 0,325x 22,4 = 7,28 lít

PT: \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
\(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
a, Ta có: \(\left\{{}\begin{matrix}m_{Fe_2O_3}=20.60\%=12\left(g\right)\Rightarrow n_{Fe_2O_3}=\dfrac{12}{160}=0,075\left(mol\right)\\m_{CuO}=20-12=8\left(g\right)\Rightarrow n_{CuO}=\dfrac{8}{80}=0,1\left(mol\right)\end{matrix}\right.\)
Theo pT: \(\left\{{}\begin{matrix}n_{Fe}=2n_{Fe_2O_3}=0,15\left(mol\right)\\n_{Cu}=n_{CuO}=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{Fe}=0,15.56=8,4\left(g\right)\)
\(m_{Cu}=0,1.64=6,4\left(g\right)\)
b, Theo PT: \(n_{H_2}=3n_{Fe_2O_3}+n_{CuO}=0,325\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,325.22,4=7,28\left(l\right)\)
Bạn tham khảo nhé!

a, mFe2O3 = 32 . 75% = 24 (g)
nFe2O3 = 24/160 = 0,15 (mol)
mCuO = 32 - 24 = 8 (g)
nCuO = 8/80 = 0,1 (mol)
PTHH:
Fe2O3 + 3H2 -> (t°) 2Fe + 3H2O
0,15 ---> 0,45 ---> 0,3
CuO + H2 -> (t°) Cu + H2O
0,1 ---> 0,1 ---> 0,1
mFe = 0,3 . 56 = 16,8 (g)
mCu = 64 . 0,1 = 6,4 (g)
b, nH2 = 0,1 + 0,45 = 0,55 (mol)
VH2 = 0,55 . 22,4 = 12,32 (l)
c, PTHH:
2Al + 6HCl -> 2AlCl3 + 3H2
11/30 <--- 1,1 <--- 11/30 <--- 0,55
mAl = 11/30 . 27 = 9,9 (g)
mHCl = 1,1 . 36,5 = 40,15 (g)

\(Fe_2O_3\left(0,075\right)+3H_2\rightarrow2Fe\left(0,15\right)+3H_2O\)
\(CuO\left(0,1\right)+H_2\rightarrow Cu\left(0,1\right)+H_2O\)
\(m_{Fe_2O_3}=20.60\%=12\left(g\right)\)
\(\Rightarrow n_{Fe_2O_3}=\dfrac{12}{160}=0,075\left(mol\right)\)
\(\Rightarrow m_{Fe}=0,15.56=8,4\left(g\right)\)
\(m_{CuO}=20.40\%=8\left(g\right)\)
\(\Rightarrow n_{CuO}=\dfrac{8}{80}=0,1\left(mol\right)\)
\(\Rightarrow m_{Cu}=0,1.64=6,4\left(g\right)\)