Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Giải thích:
Kim loại có tính khử mạnh hơn bị phá hủy trước.
Đáp án D

Chọn C.
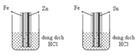
Cốc 3, 4 đều xảy ra ăn mòn điện hóa nhưng cốc 4 bị ăn mòn nhanh hơn vì Zn có tính khử mạnh hơn Fe.
Cốc 1, 2 đều xảy ra ăn mòn hóa học nhưng do Zn có tính khử mạnh hơn Fe nên cốc 1 bị ăn mòn nhanh hơn cốc 2.
Vì ăn mòn điện hóa thì kim loại bị ăn mòn nhanh hơn so với lại ăn mòn hóa học nên tốc độ giải phóng khí giảm dần theo thứ tự (4) > (3) > (1) > (2).

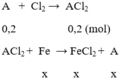
số mol FeCl2 là n = 0,25 . 0,4 = 0,1 (mol)
gọi x là số mol Fe phản ứng
khối lượng kim loại tăng là Δm = mA - mFe = Ax – 56x = 0,8
x = 0,1 → A.0,1 – 56.0,1 = 0,8 → A = 64. A là Cu
số mol Cu là nCu = 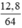 = 0,2 (mol)
= 0,2 (mol)
số mol CuCl2 → n(CuCl2) = nCu = 0,2 (mol)
nồng độ mol/l CuCl2 là C(M(CuCl2)) = 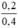 = 0,5M
= 0,5M
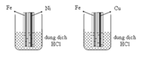
Đáp án C
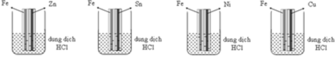
Các cặp điện cực càng cách xa nhau trong dãy điện hóa thì kim loại hoạt động hơn càng dễ bị ăn mòn và ngược lại. Suy ra thanh sắt bị hòa tan nhanh nhất khi tiếp xúc với Cu.