Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án A
Chú ý tỉ lệ dung dich X trong mỗi phản ứng
Gọi số mol ion Na+, NH4+, CO32- và SO42- trong 100ml lần lượt a, b, c, d mol
Khi cho X tác dụng với HCl chỉ có CO32- tham gia phản ứng → c = 0,1 mol
Khi cho X tác dụng với BaCl2 thu được BaCO3 và BaSO4 → 0,1.197 + d.233= 43 → d = 0,1 mol
Khi cho X tác dụng lượng dư dung dịch NaOH chỉ có NH4+ tham gia phản ứng → b = 0,2 mol
Bảo toàn điện tích trong dung dịch X → a = 2. 0,1 + 2. 0,1 -0,2 = 0,2 mol
Vậy trong 300ml dung dịch X gồm 0,6 mol Na+, 0,6 mol NH4+, 0,3 mol CO32- và 0,3 mol SO42-
→ m = 0,6.23 + 0,6. 18 + 0,3. 60 + 0,3. 96= 71,4 gam.
Đáp án A.

Chọn A
Gọi số mol Na + , NH 4 + , CO 3 2 - và SO 4 2 - trong 100ml dung dịch X lần lượt là x, y, z và t.
Bảo toàn điện tích có: x + y – 2z – 2t = 0 (1)
Cho 100ml X tác dụng với HCl dư:
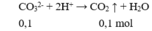
→ z = 0,1 (2)
Cho 100ml X tác dụng với BaCl2 dư:
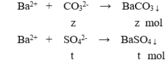
m↓ = 43 (gam) → 197z + 233t = 43 (3)
Cho 100 ml X tác dụng với NaOH
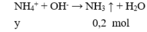
→ y = 0,2 (4)
Từ (1); (2); (3); (4) có x = y = 0,2; z = 0,1; t = 0,1.
Tổng khối lượng muối trong 300ml dung dịch là:
m = 3. (0,2.23 + 0,2.18 + 0,1.60 + 0,1.96) = 71,4 gam.

Đáp án D
2H+ +CO32- →CO2+ H2O
0,1← 0,1
Ba2++ CO32- →BaCO3
0,1→ 0,1
Ba2++ SO42- →BaSO4
0,1 ← (43-0,1.197)/233
NH4++ OH- →NH3+ H2O
0,2← 0,2
Áp dụng ĐLTBT ĐT có: 1.nNa++ 0,2.1=0,1.2+0,1.2 suy ra nNa+= 0,2 mol
tổng khối lượng muối có trong 500ml dung dịch X là: (0,2.23+0,1.60+0,1.96+0,2.18).5= 119 gam

Đáp án C
Trong 100ml dd X có 0,1 mol Ba2+, 0,15 mol .
Trong 200ml dung dịch X có 0,2 mol Cl-.
Do đó trong 50 ml dung dịch X có 0,05 mol Ba2+, 0,075 mol , 0,05 mol Cl- và x mol K+
Theo định luật bảo toàn điện tích được x = 0,025
Khi cô cạn xảy ra quá trình:


Đáp án C
+ Lấy 100 ml dung dịch X phản ứng với dung dịch NaOH dư, kết thúc các phản ứng thu được 19,7 gam kết tủa⇒ n BaCO3 = n Ba2+ 0,1 mol . Lấy 100 ml dung dịch X tác dụng với dung dịch Ba(OH)2 dư, sau khi các phản ứng kết thúc thu được 29,55 gam kết tủa
⇒ n BaCO3- = n HCO3- = 0,15 mol
⇒ Trong 100ml ddX có 0,1 mol Ba2+ , 0,15 mol HCO3- .
+ Cho 200 ml dung dịch X phản ứng với lượng dư dung dịch AgNO3, kết thúc phản ứng thu được 28,7 gam kết tủa ⇒ Trong 200ml ddX có nCl- = n AgCl = 0,2 mol
⇒ Trong 50ml ddX có 0,05 mol Ba2+ ; 0,075 mol HCO3- , 0,05 mol Cl- ⇒ nK+ = 0,025
2HCO3- → CO32- + CO2 + H2O
0,075 → 0,0375 0,0375(mol)
Khi đun sôi đến cạn: mkhan = m HCO3- + m Ba2+ + m K+ + m Cl- - m CO2 – m H2O
= 0,05.137 + 0,075.61 + 0,05.35,5 + 0,025.39 – 0,0375.44 - 0,0375.18 = 11,85g
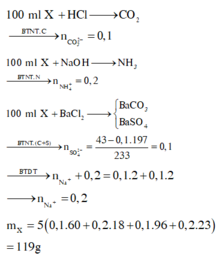

Đáp án D
Trong 100ml dd X có :
+ nCO32- = nCO2 = 0,1
+ Lấy 100 ml dung dịch X cho tác dụng với lượng dư dung dịch BaCl2 thấy có 43 gam kết tủa
⇒ mBaCO3 + mBaSO4 = 43 ⇒ mBaSO4 = 43 – 0,1.197 = 23,3g
⇒ nSO42- = 0,1
+ nNH4+ =nNH3 = 0,2
Bảo toàn điện tích ⇒ nNa+ = 0,2
⇒ Trong 500ml ddX có mmuối =5.(0,1.60 + 0,1.96 + 0,2.18 + 0,2.23) = 119g