

Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Đáp án C
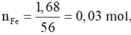
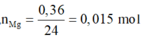
Nếu Fe và Mg phản ứng hết:
![]()
=> mCu = 64.0,045 = 2,88 g > 2,82 g
=> Chứng tò Fe phản ứng còn dư.
![]()
![]()
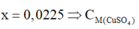
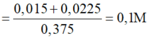

Đáp án D
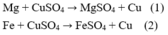
Nhận xét: khi cho bột kim loại vào dung dịch, khối lượng kim loại sau phản ứng sẽ tăng lên.
Ta có khoảng sau:


Đáp án A
Khối lượng kim loại tăng: 1,88 – (1,12 + 0,24) = 0,52 (gam)
Trước hết, Mg tác dụng với CuSO4
Mg + CuSO4 → MgSO4 + Cu (1)
nMg = 0,1 mol ⇒ nCuSO4 =0,1 mol
Từ (1) ⇒ 0,1 mol Mg tác dụng với 0,1 mol CuSO4 sinh ra 0,01 mol Cu đã làm cho khối lượng kim loại tăng:
0,01.(64 – 24) = 0,4 (gam)
⇒Phản ứng giữa Fe và CuSO4 làm cho khối lượng kim loại tăng:
0,52 – 0,4 =0,12 g
Fe + CuSO4 → FeSO4 + Cu (2)
![]()
Vậy:


Đáp án D
![]()
Vì dung dịch Y vẫn còn màu xanh nên Y vẫn còn chứa Cu2+ chưa bị điện phân.
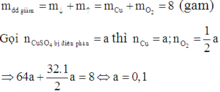
Khi cho Fe vào dung dịch Y có phản ứng:
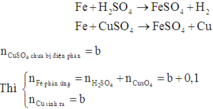
Theo định luật bảo toàn khối lượng, ta có:
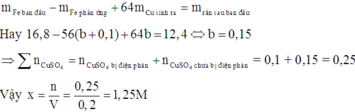

Khối lượng kim loại tăng là : 1,88 - 1,12 - 0,24 = 0,52 (g)
Mg là kim loại mạnh hơn Fe nên Mg phản ứng trước.
Mg + CuSO4 → MgSO4 + Cu (1)
0,01 → 0,01 (mol)
Mg phản ứng hết làm khối lượng tăng là :
64 . 0,01 - 24 . 0,01 = 0,40 (g)
Phản ứng của Fe làm khối lượng tăng thêm là : 0,52 - 0,40 = 0,12(g)
Fe + CuSO4 → FeSO4 + Cu (2)
Theo (2), ta có:
1 mol CuSO4 phản ứng làm khối lượng tăng 64 - 56 = 8 (g)
x mol <-------------------------------------------------- 0,12 g
x=0,128=0,015(mol)x=0,128=0,015(mol)
Số mol Fe ban đầu là 1,1256=0,02(mol)>0,0151,1256=0,02(mol)>0,015
Vậy Fe còn dư và CuSO4 hết.
Nồng đô mol của CuSO4 là : (0,01+0,015).1000250=0,1M(0,01+0,015).1000250=0,1M.