Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B.
nFe = 0,2 mol; nZn = 0,1 mol
NaOH + H2S→NaHS + H2O
![]()

Đáp án B
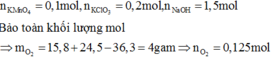
Khi cho hỗn hợp Y phản ứng với HCl đặc sẽ xảy ra phản ứng oxi hóa – khử tạo ra Cl2
![]()
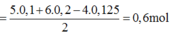


Ta thấy khi cho Br 2 vào dung dịch 2 muối S 4 + thì toàn bộ S 4 + sẽ bị oxi hoá lên S 6 + ( SO 4 2 - )do đó :
n SO 2 = n SO 4 2 - = 0,15
=> m BaSO 4 = 0,15.233 = 34,95g

\(H_2S + CuSO_4 \to CuS + H_2SO_4\)
\(n_{H_2S} = n_{CuSO_4} = \dfrac{800.1,2.10\%}{160} = 0,6(mol)\\\)
Gọi : \(\left\{{}\begin{matrix}n_{Fe}=a\left(mol\right)\\n_{Zn}=b\left(mol\right)\end{matrix}\right.\)⇒ 56x + 65b = 37,2(1)
\(Fe +S \xrightarrow{t^o}FeS\\ Zn + S\xrightarrow{t^o}ZnS\\ FeS + 2HCl \to FeCl_2 + H_2S\\ ZnS + 2HCl \to ZnCl_2 + H_2S\\\)
Theo PTHH :
\(n_{H_2S} = a + b = 0,6(2)\)
Từ (1)(2) suy ra a = 0,2; b = 0,4
Vậy :
\(m_{Fe} = 0,2.56 = 11,2(gam)\\ m_{Zn} = 0,4.65 = 26(gam)\)



Cứu tui
\(n_{ZnS}=\frac{29,1}{97}=0,3mol\)
BT (S): \(n_{H_2S}=n_{ZnS}=0,3mol\)
\(\left\{{}\begin{matrix}Zn\\ZnS\end{matrix}\right.\underrightarrow{H_2SO_4l}^{ }_{ }\uparrow\left\{{}\begin{matrix}H_2\\H_2S\end{matrix}\right.\)
Chỉ có H2S bị NaOH hấp thụ thành Na2S
nNaOH=1,75.0,1=0,175 mol
2NaOH + H2S -> Na2S + H2O
Bđ: 0,175 0,3
Pứ: 0,175 -> 0,0875 -> 0,0875
Còn: - 0,2125 0,0875
Dung dịch sau có Na2S và H2S.
\(\left\{{}\begin{matrix}m_{Na_2S}=0,0875.78=6,825g\\m_{H_2S}=0,2125.34=7,225g\end{matrix}\right.\)