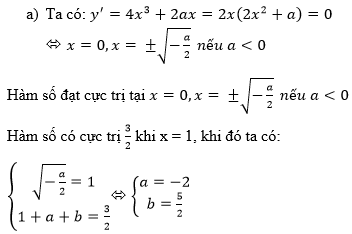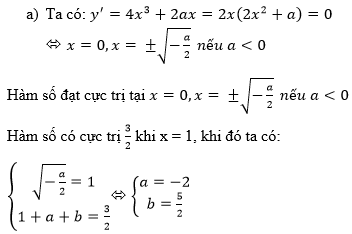Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Este X tạo từ 1 axit 2 chức và 2 ancol đơn chức nên este X là este hai chức.
Đặt công thức của este là CnH2n+2-2kO4
*Đốt cháy: CnH2n+2-2kO4 + (3n-k-3)/2 O2 → nCO2 + (n+1-k) H2O
Số mol CO2 bằng số mol O2 => n = (3n-k-3)/2 => n = k + 3
*X phản ứng vừa hết với 2 mol H2 nên X có 2 π ở gốc hidrocacbon.
Ta thấy: X có 2π ở gốc hidrocacbon và 2π ở nhóm COO => k = 2 + 2 = 4
=> n = 7 => X là C7H8O4
*Y là este hai chức, no, mạch hở tác dụng với NaOH thu được A, B, C trong đó B, C thuộc cùng dãy đồng đẳng nên B, C là 2 ancol no, đơn chức. Khi đun nóng B với H2SO4 đặc ở 170oC không thu được anken nên B là CH3OH
=> C là C2H5OH
Vậy:
X là CH3OOC-C≡C-COOC2H5;
Y là CH3OOC-CH2-CH2-COOC2H5
A là NaOOC-C≡C-COONa
Xét các nhận định:
(1) Chất X có CTPT là C7H8O4 => đúng
(2) Chất A có CTPT là C4H2O4Na => sai, A có CTPT là C4O4Na2
(3) Chất C là ancol etylic => đúng
(4) Hai chất X và Y đều có mạch không phân nhánh => đúng
Vậy có tất cả 3 nhận định đúng
Đáp án cần chọn là: C

Đáp án A.
Phát biểu đúng là: (1); (2); (3); (5).
(3) 4Fe(NO3)2![]() 2Fe2O3 + 8NO2 + O2.
2Fe2O3 + 8NO2 + O2.
4FeCO3 + O2![]() 2Fe2O3 + 4CO2
2Fe2O3 + 4CO2
4Fe(NO3)3![]() 2Fe2O3 + 12NO2 + 3O2.
2Fe2O3 + 12NO2 + 3O2.
(4) Trong quá trình điện phân dung dịch NaCl có màng ngăn, cực âm của bình điện phân được làm bằng thép, còn cực dương làm bằng than chì

Đáp án B
• Xét tại thời điểm th; dung dịch sau điện phân hòa tan Al sinh ra H2 mà tỷ lệ CuSO4 : NaCl = 1:1 nên.
Đặt số mol CuSO4 và NaCl đều là b mol.
Ở catot: Cu2+ + 2e → Cu0; ở anot: 2Cl- - 2e → Cl2 ; 2H2O – 4e → 4H+ + O2.
Dung dịch X Phản ứng với Al sinh ra a mol H2 → lượng H+ đã phản ứng = 2a mol.
||→ Số mol e trao đổi = b + 2a mol .
• Xét tại thời điểm 2th, số mol e trao đổi = 2 (2a + b) mol.
Ở catot: Cu2+ + 2e → Cu0 ; 2H2O + 2e → 2OH- + H2 || Ở anot: 2Cl- - 2e → Cl2 ; 2H2O – 4e → 4H+ + O2.
Số mol e Cl- nhường = b mol → số mol e H2O nhường = 4a + b mol → Lượng H+ sinh ra = 4a + b
Số mol e Cu2+ nhận = 2b mol → Số mol e H2O nhận = 4a mol → số mol OH- = 4a mol.
Trong dung dịch có OH- và H+ nên : H+ + OH- → H2O.
||→ Lượng H+ dư = b mol.
Cho Al dư vào dung dịch: Al + 3H+ → Al3+ + 3/2 H2.
||→ Số mol H2 = b /2 = 4a → a : b = 1 : 8
• Xét các nhận định:
+ Tại thời điểm 2th số mol khí thoát ra ở hai cực là: 2a + 0,5 b + 0,25 (4a + b ) , thay b = 8 a → số mol khí thoát ra = 9a mol → (1) đúng.
+ Tại thời điểm 1,75t h thì số mol e trao đổi = 1,75 (2a + b) mol.
Nếu H2O điện phân thì Cu2+ điện phân hết → số mol e Cu2+ nhận = 2b mol < 1,75 (2a + b)
||→ 0,25b < 3,5a → a : b < 1 / 3 đúng (do a : b = 0,75). → (2) đúng.
+ Tại thời điểm 1,5t h thì số mol e trao đổi = 1,5 (2a + b) mol.
Nếu H2O điện phân thì Cu2+ điện phân hết → số mol e Cu2+ nhận = 2b mol < 1,5 (2a + b)
||→ 0,5b < 3a → a : b < 1 / 6 → đúng (do a : b = 1:8 ). → (3) đúng.
+ Tại thời điểm 0,8t h thì số mol e trao đổi = 0,8 (2a + b) mol.
Nếu H2O điện phân thì Cl- điện phân hết → số mol e Cl- nhường= b mol < 0,8 (2a + b)
||→ 0,2b < 1,6 a → a : b < 1 / 8 đúng (do a : b = 1:8). → (4) đúng.
+ Tại thời điểm 2th thì số mol H2 sinh ra = 2a mol. → (5) sai.

a) Gọi công thức ankan là C2H2n+2 => công thức anken là CnH2n
coi hỗn hợp đầu có 1 mol => mX = 0,5.(14n +2) + 0,5.14n = 14n + 1
Y chỉ có ankan => mY = 0,5.(14n + 2) = 7n + 1
theo đề bài: (7n + 1)/(14n + 1) = 15/29
<=> n = 2
=> công thức: C2H6 và C2H4
b) cho qua Br2 chỉ có anken phản ứng, thể tích giảm 1/2
=> mỗi chất chiếm 1/2 thể tích hay 50% thể tích

Đáp án D
MX = 27
nX = 3,24 : 27 = 0,12 mol → số C =
→ X có CHxOy : a mol và C2HzOt : b mol ( x ≤4, z ≤6) → a + b = 0,12 và a + 2b = 1,75.0,12 = 0,21
→ a = 0,03 và b = 0,09 mol
→ 0,03(12 + x + 16y ) + 0,09. ( 24 + z + 16t) = 3,24 → x + 16y + 3z + 48t = 24
Thỏa mãn x = 2, y = 1, z =1 và t=0
A : C2H2 : 0,09 mol và B : CH2O : HCHO : 0,03 mol
(1) sai
(2) đúng
(3) sai. 1 mol B → 4 mol Ag
(4) đúng
(5) sai
(6) đúng
Số đáp án sai là 3