Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi công thức hóa học của oxit sắt là F e x O y
PTHH của phản ứng là:
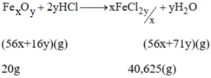
Theo PTHH ta có:
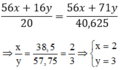
Vậy công thức hóa học của oxit sắt là F e 2 O 3

Cho 3,6g một oxit sắt vào dung dịch HCl dư. Sau khi phản ứng xảy ra hoàn toàn thu được một muối sắt clorua. Hãy xác định công thức phân tử của oxit sắt

Giả sử oxit cần tìm là FexOy.
PT: \(Fe_xO_y+2yHCl\rightarrow xFeCl_{\dfrac{2y}{x}}+yH_2O\)
Ta có: \(n_{Fe_xO_y}=\dfrac{40}{56x+16y}\left(mol\right)\)
\(n_{FeCl_{\dfrac{2y}{x}}}=\dfrac{81,25}{56+\dfrac{71y}{x}}\left(mol\right)\)
Theo PT: \(n_{Fe_xO_y}=\dfrac{1}{x}n_{FeCl_{\dfrac{2y}{x}}}\)
\(\Rightarrow\dfrac{40}{56x+16y}=\dfrac{1}{x}.\dfrac{81,25}{56+\dfrac{71y}{x}}\) \(\Rightarrow\dfrac{x}{y}=\dfrac{2}{3}\)
Vậy: CTHH cần tìm là Fe2O3

Gọi công thức oxit sắt là FexOy.
Phương trình hóa học của phản ứng:
FexOy + 2yHCl \(\rightarrow\) xFeCl2y/x + yH2O
(56x+16y)g (56x+71y)g
20g 40,625g
Theo phương trình háo học trên,ta có:
40,625 x (56x + 16y) = 20 x (56x + 71y)
\(\rightarrow\) \(\dfrac{x}{y}\) = \(\dfrac{38,5}{57,75}\) = \(\dfrac{2}{3}\)
Công thức phân tử của oxit sắt là Fe2O3.
CHÚC BẠN HỌC TỐT!!
Đặt CTHH của oxit sắt là \(Fe_xO_y\)
\(Fe_xO_y+2yHCl-->xFeCl_{\dfrac{2y}{x}}+yH_2O\left(1\right)\)
\(n_{Fe_xO_y}=\dfrac{20}{56x+16y}\)
\(n_{FeCl_{\dfrac{2y}{x}}}=\dfrac{40,625}{56+\dfrac{2y}{x}.35,5}\)
\(\left(1\right)=>\dfrac{20}{56x+16y}.x=\dfrac{40,625}{56+\dfrac{71y}{x}}\)
Giai phương trình trên : \(x=2;y=3\)
\(CTHH:Fe_2O_3\)

Hơi làm biếng viết chỉ số cho rõ nên chịu khó coi giùm mk
Gọi CT oxit sắt: FexOy
FexOy + 2yHCl => xFeCl2y/x + yH2O
Theo đề bài, ta có:
\(\frac{32x}{56x+16y}=\frac{65}{56+71\frac{y}{x}}\)
1792x + 2272y = 3640x + 1040y
1848x = 1232y => x/y = 2/3
CT: Fe2O3

\(n_{H_2O}=\dfrac{5,4}{18}=0,3\left(mol\right)\)
Bảo toàn O: \(n_{O\left(oxit\right)}=n_{H_2O}=0,3\left(mol\right)\)
\(n_{FeCl_2}=\dfrac{25,4}{127}=0,2\left(mol\right)\)
PTHH: Fe + 2HCl ---> FeCl2 + H2
0,2 <-------------- 0,2
CTHH của oxit FexOy
=> x : y = 0,2 : 0,3 = 2 : 3
CTHH Fe2O3

\(CT:Fe_xO_y\)
\(Fe_xO_y+yH_2\underrightarrow{^{t^o}}xFe+yH_2O\left(1\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\left(2\right)\)
\(n_{Fe}=n_{H_2\left(2\right)}=\dfrac{4.032}{22.4}=0.18\left(mol\right)\)
\(n_{H_2\left(1\right)}=\dfrac{y}{x}\cdot n_{Fe}=\dfrac{5.376}{22.4}=0.24\left(mol\right)\)
\(\Leftrightarrow\dfrac{y}{x}\cdot0.18=0.24\)
\(\Leftrightarrow\dfrac{x}{y}=\dfrac{3}{4}\)
\(CT:Fe_3O_4\)
\(m_{Fe_3O_4}=\dfrac{0.18}{3}\cdot232=13.92\left(g\right)\)
Giả sử công thức phân tử của oxit sắt là FexOy , phương trình phản ứng :
FexOy + 2yHCl \(\rightarrow\)xFeCl2y/x + yH2O
(56x+16y)g---------(56x+71y)g
7,2g-------------------12,7g
Theo phương trình phản ứng , ta có :
7,2(56x+71y) = 12,7(56x+16y)
\(\Leftrightarrow\)308x = 308y \(\Leftrightarrow\dfrac{x}{y}=\dfrac{1}{1}\)
Công thức oxit sắt là FeO
CTHH dạng TQ của oxit sắt là FexOy
PTHH :
FexOy + 2yHCl \(\rightarrow\) xFeCl2y/x + yH2O
- Vì t/d với HCl dư => oxit sắt hết
Đặt nHCl(Pứ) = a(mol) => mHCl(pứ) = 36,5a(g)
Theo PT => nH2O = 1/2 . nHCl = 1/2 .a(mol)
=> mH2O = 1/2 . a . 18 =9a(g)
Theo ĐLBTKL:
mFexOy + mHCl(pứ) = mmuối + mH2O
=> 7,2 + 36,5a = 12,7 + 9a
=>a = 0,2(mol)
=> nH2O = 1/2 . a = 1/2 . 0,2 = 0,1(mol)
=> nO / H2O = 0,1(mol)
=> mO / H2O = 0,1 . 16 = 1,6(g)
Theo ĐLBTKL :
mO / FexOy = mO / H2O = 1,6(g)
=> mFe / FexOy = mFexOy - mO / FexOy = 7,2 - 1,6 = 5,6(g)
=> nFe/FexOy = 5,6/56 = 01,(mol)
Ta Có :
x : y = nFe / FexOy : nO / FexOy = 0,1 : 0,1 = 1 : 1
=> x = y =1
=> CTHH của oxit sắt là FeO