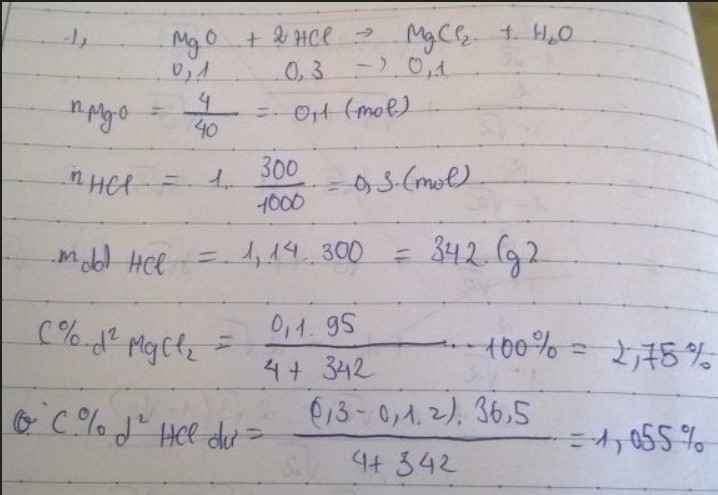Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Phương trình phản ứng: Fe + CuSO4 → FeSO4 + Cu b) Số mol của Fe là : 1,96 : 56 = 0,035 (mol) Khối lượng dd CuSO4 là : m ddCuSO4 = 1,12 . 100 = 112 (g) Khối lượng CuSO4 có trong dd là :
mCuSO4 = 10% . 112 = 11,2 (g)
Số mol của CuSO4 là :
11,2 : 160 = 0,07 mol
Fe + CuSO4 ——> FeSO4 + Cu (1)
Theo (1) ta có : nFe = nCuSO4 = 0,07 mol > 0,035 mo
l => số mol của CuSO4 dư
Vậy ta tính theo số mol của Fe.
CM CuSO4 = (0,07 – 0,035/100)*1000 = 0,35 (M)
CM FeSO4 = (0,035/100)*1000 = 0,35 (M)

2.nung hỗn hợp gồm 22.4 sắt và 8g lưu huỳnh trong môi trường không có không khí. Sau phản ứng thu được hỗn hợp chất rắn A. Cho dung dịch HCL 1M phản ứng vừa đủ với A thu được hỗn hợp khí B. Tính thể tích dung dịch HCL 1M đã tham gia phản ứng
\(n_{Fe}=\dfrac{22,4}{56}=0,4\left(mol\right);n_S=\dfrac{8}{32}=0,25\left(mol\right)\)
PTHH : Fe + S -------to------> FeS
Theo đề: 0,4.......0,25 (mol)
Lập tỉ lệ : \(\dfrac{0,4}{1}>\dfrac{0,25}{1}\)=> Sau phản ứng Fe dư
=> \(n_{Fe\left(dư\right)}=0,4-0,25=0,15\left(mol\right)\)
Fe + 2HCl ------> FeCl2 + H2
FeS + 2HCl ------> FeCl2 + H2S
\(V_{HCl}=\dfrac{0,15.2+0,25.2}{1}=0,8\left(l\right)\)
1.cho 1,4g bột sắt vào 100ml dung dịch CuSO4 10% có khối lượng riêng là 1,12g/ml. Xác định nồng độ mol của chất tronh dung dịch khi phản ứng kết thúc. Giả thiết rằng thể tích của dung dịch sau phản ứng thay đổi không đáng kể
PTHH: Fe + CuSO4 → FeSO4 + Cu
\(n_{Fe}=\dfrac{1,4}{56}=0,025\left(mol\right)\)
m ddCuSO4 = 1,12 . 100 = 112 (g)
=> m CuSO4 = 10% . 112 = 11,2 (g)
=> \(n_{CuSO_4}=\dfrac{11,2}{160}=0,07\left(mol\right)\)
Theo PT, lập tỉ lệ nFe : nCuSO4 = \(\dfrac{0,025}{1}< \dfrac{0,07}{1}\) => CuSO4 dư sau phản ứng
\(CM_{CuSO_4\left(dư\right)}=\dfrac{0,07-0,025}{0,1}=0,45M\)
\(CM_{FeSO_4}=\dfrac{0,025}{0,1}=0,25M\)

Bài 4 :
\(n_{MgO}=\dfrac{4}{40}=0,1\left(mol\right)\)
300ml = 0,3l
\(n_{HCl}=1.0,3=0,3\left(mol\right)\)
1) Pt : \(MgO+2HCl\rightarrow MgCl_2+H_2O|\)
1 2 1 1
0,1 0,3 0,1
2) Lập tỉ số so sánh : \(\dfrac{0,1}{1}< \dfrac{0,3}{2}\)
⇒ MgO phản ứng hết , HCl dư
⇒ Tính toán dựa vào số mol của MgO
\(n_{MgCl2}=\dfrac{0,1.1}{1}=0,1\left(mol\right)\)
⇒ \(m_{MgCl2}=0,1.95=9,5\left(g\right)\)
\(n_{HCl\left(dư\right)}=0,3-\left(0,1.2\right)=0,1\left(mol\right)\)
⇒ \(m_{HCl\left(dư\right)}=0,1.36,5=3,65\left(g\right)\)
\(m_{ddHCl}=1,14.300=342\left(g\right)\)
\(m_{ddspu}=4+342=346\left(g\right)\)
\(C_{MgCl2}=\dfrac{9,5.100}{346}=2,75\)0/0
\(C_{HCl\left(dư\right)}=\dfrac{3,65.100}{346}=1,05\)0/0
Chúc bạn học tốt

Số mol của đồng (II) oxit
nCuO = \(\dfrac{m_{CuO}}{M_{CuO}}=\dfrac{1,6}{80}=0,02\left(mol\right)\)
Khối lượng của axit sunfuric
C0/0H2SO4 = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{ct}=\dfrac{C.m_{dd}}{100}=\dfrac{20.100}{100}=20\left(g\right)\)
Số mol của axit sunfuric
nH2SO4 = \(\dfrac{m_{H2SO4}}{M_{H2SO4}}=\dfrac{20}{98}=0,2\left(mol\right)\)
Pt : CuO + H2SO4 → CuSO4 + H2O\(|\)
1 1 1 1
0,02 0,2 0,02
Lập tỉ số so sánh : \(\dfrac{0,02}{1}>\dfrac{0,2}{1}\)
⇒ CuO phản ứng hết , H2SO4 dư
⇒ Tính toán dựa vào số mol của CuO
Số mol của đồng (II) sunfat
nCuSO4 = \(\dfrac{0,02.1}{1}=0,02\left(mol\right)\)
Khối lượng của đồng (II) sunfat
mCuSO4 = nCuSO4 . MCuSO4
= 0,02 . 160
= 3,2 (g)
Số mol dư của dung dịch axit sunfuric
ndư = nban đầu - nmol
= 0,2 - (0,02 . 1)
= 0,18 (mol)
Khối lượng dư của dung dịch axit sunfuric
mdư= ndư . MH2SO4
= 0,18. 98
= 17,64 (g)
Khối lượng dư của dung dịch axit sunfuric
mdung dịch sau phản ứng = mCuO + mH2SO4
= 1,6 + 100
= 101,6 (g)
Nồng độ mol của đồng (II) sunfat
C0/0CuSO4 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{3,2.100}{101,6}=3,15\)0/0
Nồng độ phần trăm của dung dịch axit sunfuric
C0/0H2SO4 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{17,64.100}{101,6}=17,36\)0/0
Chúc bạn học tốt