Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Ta có nMg = 6,72/24 = 0,28 mol; nMgO = 0,8/40 = 0,02 mol; nX = 0,04 mol
Do Mg và MgO tác dụng hết tạo ra Mg(NO3)2 nên mMg(NO3)2 = 148.(0,28 + 0,02) = 44,4g
Mà đề cho mmuối = 46g > 44,4g ⇒ Có thêm muối NH4NO3
⇒ mNH4NO3 = 46 – 44,4 = 1,6g ⇒ nNH4NO3 = 1,6/80 = 0,02 mol

Từ nhỗn hợp khí và tỉ khối hơi ⇒ nN2O = 0,01 và nNO = 0,03.
nNaOH trung hòa = nHNO3 dư = 0,04 mol
⇒ Sơ đồ tóm tắt ta có:
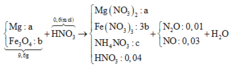
PT theo m hỗn hợp: 24a + 232b = 9,6 (1)
PT bảo toàn e: 2a + b – 8c = 0,01×8 + 0,03×3 = 0,17 (2)
PT theo ∑nHNO3: 2nO/Fe3O4 + 10nN2O + 4nNO + 10nNH4NO3 + nHNO3 dư.
→ 8b + 10c = 0,34 (3)
+ Giải hệ ta có: a = 0,11; b = 0,03; c = 0,01.

Đáp án A



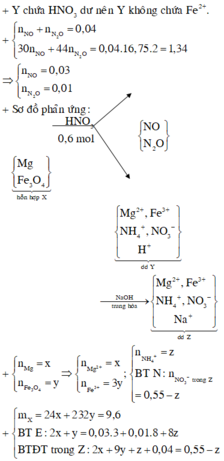
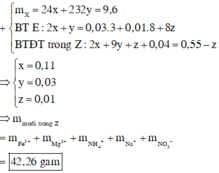
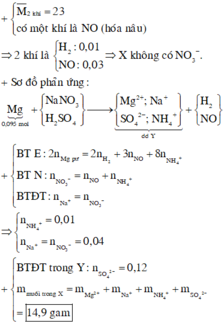
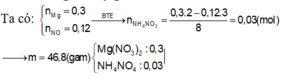
Chọn đáp án B
nMg = 0,09 mol; nNO = 0,04 mol || Mg là kim loại hoạt động mạnh ⇒ chú ý có muối amoni!
Bảo toàn electron: 2nMg = 3nNO + 8nNH4NO3 ⇒ nNH4NO3 = 0,0075 mol.
► Muối gồm 0,09 mol Mg(NO3)2 và 0,0075 mol NH4NO3 ⇒ mmuối khan = 13,92(g) ⇒ chọn B.