Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

PTHH: \(Fe_2\left(SO_4\right)_3+6NaOH\rightarrow3Na_2SO_4+2Fe\left(OH\right)_3\downarrow\)
\(Al_2\left(SO_4\right)_3+6NaOH\rightarrow3Na_2SO_4+2Al\left(OH\right)_3\downarrow\)
Ta có: \(n_{NaOH\left(p/ứ\right)}=6n_{Fe_2\left(SO_4\right)_3}+6n_{Al_2\left(SO_4\right)_3}=6\cdot\left(\dfrac{8}{400}+\dfrac{13,68}{342}\right)=0,36\left(mol\right)\)
Mà \(\Sigma n_{NaOH}=\dfrac{16,8}{40}=0,42\left(mol\right)\) \(\Rightarrow n_{NaOH\left(dư\right)}=0,06\left(mol\right)\)
PTHH: \(NaOH+Al\left(OH\right)_3\rightarrow NaAlO_2+2H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{Al\left(OH\right)_3}=2n_{Al_2\left(SO_4\right)_3}=0,08\left(mol\right)\\n_{NaOH\left(dư\right)}=0,06\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) NaOH p/ứ hết
\(\Rightarrow\left\{{}\begin{matrix}n_{Na_2SO_4}=0,04\cdot3+0,02\cdot3=0,18\left(mol\right)\\n_{NaAlO_2}=0,06\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}C_{M_{Na_2SO_4}}=\dfrac{0,18}{0,5}=0,36\left(M\right)\\C_{M_{NaAlO_2}}=\dfrac{0,06}{0,5}=0,12\left(M\right)\end{matrix}\right.\)

1) \(n_{Al\left(OH\right)_3}=\dfrac{0,78}{78}=0,01\left(mol\right)\)
PTHH: \(Al_2\left(SO_4\right)_3+6NaOH\rightarrow3Na_2SO_4+2Al\left(OH\right)_3\)
0,03<----------------------0,01
=> nNaOH min = 0,03 (mol)
=> \(C_{M\left(NaOH\right)}=\dfrac{0,03}{0,2}=0,15M\)
2) \(n_{Al_2O_3}=\dfrac{5,1}{102}=0,05\left(mol\right)\)
\(n_{Al_2\left(SO_4\right)_3}=0,3.0,25=0,075\left(mol\right)\)
PTHH: \(6NaOH+Al_2\left(SO_4\right)_3\rightarrow3Na_2SO_4+2Al\left(OH\right)_3\)
0,45<------0,075-------------------------->0,15
\(NaOH+Al\left(OH\right)_3\rightarrow NaAlO_2+2H_2O\)
0,05<----0,05
\(2Al\left(OH\right)_3\underrightarrow{t^o}Al_2O_3+3H_2O\)
0,1<-------0,05
=> nNaOH max = 0,5 (mol)
=> \(V_{dd}=\dfrac{0,5}{2}=0,25\left(l\right)=250\left(ml\right)\)
3)
\(n_{KOH\left(1\right)}=0,15.1,2=0,18\left(mol\right)\)
\(n_{Al\left(OH\right)_3\left(1\right)}=\dfrac{4,68}{78}=0,06\left(mol\right)\)
\(n_{AlCl_3}=0,1.x\left(mol\right)\)
Do khi cho KOH tác dụng với dd Y xuất hiện kết tủa
=> Trong Y chứa AlCl3 dư
PTHH: \(3KOH+AlCl_3\rightarrow3KCl+Al\left(OH\right)_3\)
0,18---->0,06----------------->0,06
\(n_{KOH\left(2\right)}=0,175.1,2=0,21\left(mol\right)\)
\(n_{Al\left(OH\right)_3\left(2\right)}=\dfrac{2,34}{78}=0,03\left(mol\right)\)
PTHH: \(3KOH+AlCl_3\rightarrow3KCl+Al\left(OH\right)_3\)
(0,3x-0,18)<--(0,1x-0,06)------->(0,1x-0,06)
\(KOH+Al\left(OH\right)_3\rightarrow KAlO_2+2H_2O\)
(0,1x-0,09)<-(0,1x-0,09)
=> \(\left(0,3x-0,18\right)+\left(0,1x-0,09\right)=0,21\)
=> x = 1,2

nHCl = 0,4.0,5 = 0,2 mol; nH2SO4 = 0,08.0,5 = 0,04 mol
nH+ = nHCl + 2nH2SO4 = 0,28 mol
Đặt số mol của Zn và Mg trong hỗn hợp ban đầu là x và y (mol)
Ta có: 65x + 24y = 5,34 (1)
Zn + 2H+ → Zn2+ + H2
x → 2x → x (mol)
Mg + 2H+ → Mg2+ + H2
y → 2y → y (mol)
Dung dịch Y gồm có:
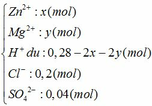
Ta thấy: nH+ + 2nZn2+ + 2nMg2+ (= 0,28 mol) < nNaOH (= 0,3 mol)
=> NaOH dư, Zn(OH)2 bị tan một phần
=> nNaOH hòa tan kết tủa = 0,3 – 0,28 = 0,02 mol
H+ + OH- → H2O
0,28-2x-2y → 0,28-2x-2y (mol)
Zn2+ + 2OH- → Zn(OH)2
x → 2x → x (mol)
Mg2+ + 2OH- → Mg(OH)2
y → 2y → y (mol)
Zn(OH)2 + 2OH- → ZnO22- + H2O
0,01 ← 0,02 (mol)
Khối lượng kết tủa thu được sau phản ứng: m kết tủa = mMg(OH)2 + mZn(OH)2
=> 99(x-0,01) + 58y = 8,43 <=> 99x + 58y = 9,42 (2)
Từ (1) và (2) ta có:

Ta có: nKOH : nBa(OH)2 = 0,4:0,05 = 8
Giả sử số mol của KOH và Ba(OH)2 lần lượt là 8a và a (mol)
=> nBa2+ = a (mol); nOH- = nKOH + 2nBa(OH)2 = 10a (mol)
- Khi kết tủa Mg(OH)2 và Zn(OH)2 đạt giá trị lớn nhất: nOH- = nH+ dư + 2nZn2+ + 2nMg2+
=> 10a = 0,04 + 2.0,06 + 2.0,06 => a = 0,028 mol
Ta thấy a < nSO42- => BaSO4 chưa đạt cực đại
- Giả sử sau khi Mg(OH)2 và Zn(OH)2 đạt cực đại ta thêm 8b mol KOH và b mol Ba(OH)2:
+ Lượng kết tủa sinh thêm là lượng BaSO4: nBaSO4 = nBa(OH)2 = b mol
=> mBaSO4 = 233b (gam)
+ Lượng kết tủa bị tan ra: nZn(OH)2 = nOH-: 2 = 10b : 2 = 5b (mol)
=> mZn(OH)2 = 99.5b = 495b (gam)
Ta thấy khối lượng kết tủa sinh ra nhỏ hơn khối lượng kết tủa bị tan nên khối lượng kết tủa lớn nhất là thời điểm Mg(OH)2 và Zn(OH)2 đạt cực đại. Khi đó: nBa(OH)2 = a = 0,028 mol
=> V = 0,028 : 0,05 = 0,56 (lít)
Kết tủa sau phản ứng gồm có:
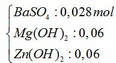
Mg(OH)2 → t ∘ MgO + H2O
0,06 mol → 0,06 mol
Zn(OH)2 → t ∘ ZnO + H2O
0,06 mol → 0,06 mol
=> m = mBaSO4 + mMgO + mZnO = 0,028.233 + 0,06.40 + 0,06.81 = 13,784 gam

mddH2SO4 = 100 . 1,137 = 113,7
nH2SO4 = 113,7 . 20%/98 = 0,232 mol
nBaCl2 = 400 . 5,29%/208 = 0,1 mol
H2SO4 + BaCl2 —> BaSO4 + 2HCI
Bđ: 0,232 0,1
Pứ: 0,1 0, 1 0,1 0,2
Sau pứ: 0,132 0
mBaSO4 = 0,1.233 = 23,3 gam
Khối lượng dung dịch sau khi lọc bỏ kết tủa:
mddB = mddH2SO4 + mddBaCl2 - mBaSO4 = 490,4
C%HCI = 0,2.36,5/490,4 = 1,49%
C%H2SO4 dư = 0,132.98/490,4 = 2,64%


\(n_{Al_2(SO_4)_3}=0,1.0,2=0,02(mol)\\ n_{KOH}=0,2.0,3=0,06(mol)\\ PTHH:Al_2(SO_4)_3+6KOH\to 2Al(OH)_3\downarrow+3K_2SO_4\)
Vì \(\dfrac{n_{Al_2(SO_4)_3}}{1}>\dfrac{n_{KOH}}{6}\) nên \(Al_2(SO_4)_3\) dư
\(a,n_{K_2SO_4}=\dfrac{1}{2}n_{KOH}=0,3(mol)\\ n_{Al(OH)_3}=\dfrac{1}{3}n_{KOH}=0,2(mol)\\ \Rightarrow m_{Al(OH)_3}=0,2.78=15,6(g)\\ C_{M_{K_2SO_4}}=\dfrac{0,3}{0,5}=0,6M\)
\(b,K_2SO_4\) ko tác dụng được với \(KOH\), bạn xem lại đề
thế dd X chứa gì
K2SO4 kh tác dụng đc mà Al2(SO4)3 tác dụng đc mà