Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chọn đáp án C.
Hỗn hợp sau nung chứa 2 oxit là MgO và Fe2O3
chứng tỏ Mg và Zn phản ứng hết, Fe2(SO4)3 và CuSO4 phản ứng hết, FeSO4 còn dư.
Đặt y là số mol FeSO4 đã phản ứng
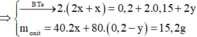

⇒ m C u + m F e = 17 , 44 g

Đáp án C
Ta có: n F e 2 ( S O 4 ) 3 = 0 , 1 m o l ; n C u S O 4 = 0 , 15 m o l
Do nung kết tủa ngoài không khí thu được 15,2 gam hỗn hợp 2 oxit nên 2 oxit là MgO và Fe2O3 (Zn(OH)2 bị hòa tan trong NaOH dư) do vậy Cu hết và Fe3+ hết
Gọi số mol Zn là a → số mol Mg là 2a.
→ n F e 3 + t r o n g Y = 0 , 1 . 2 . 3 + 0 , 15 . 2 - 2 a . 2 - 2 a 2 = 0 , 45 - 3 a
Vậy oxit gồm 2a mol MgO và 0,225-1,5a mol Fe2O3
=> 40.2a+160(0,225-1,5a)= 15,2
Giải được: a=0,13
Rắn Z thu được gồm Cu 0,15 mol và Fe 0,14 mol (bảo toàn Fe)
→ m = 17 , 44 g a m

Chọn đáp án C
0,725m gam hỗn hợp kim loại ||→ rõ có mỗi 2 kim loại là Fe và Cu rồi.
Phản ứng hoàn toàn, Fe còn dư → chứng tỏ trong dung dịch chỉ có Fe2+.
Oh.! đọc ra luôn từ anion là 0,15 mol FeSO4 và 0,1 mol FeCl2.
♦ BTKL kim loại có ngay: m + 0,15 × 64 = (0,15 + 0,1) × 56 + 0,725m
||→ giải ra m = 16,0 gam. Chọn đáp án C.

Đáp án A
Dung dịch sau phản ứng chứa FeSO4: 0,15 và FeCl2: 0,1 → m - 0,25.56 + 0,15.64 = 0,725m → m = 16

Đáp án B
Hướng dẫn tư duy 1: Cân bằng phương trình
![]()
Hướng dẫn tư duy 2: Sử dụng bảo toàn e
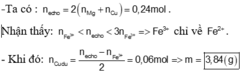
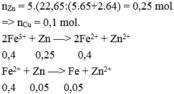


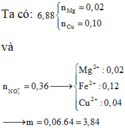
Đáp án B
Đặt nZn = x mol ; nCu =2x mol
=> m hỗn hợp = 65x +64.2x =19,3 g => x = 0,1 mol
Có nFe3+ = 0,4 mol ,Xảy ra các quá trình sau:
Zn + 2Fe3+ → Zn 2+ + 2Fe2+
Mol 0,1 -> 0,2
Cu +2 Fe3+ → Cu 2+ + 2Fe2+ Mol 0,1 <- 0,2
=> m = mCu dư = 0,1 .64 = 6,4g