Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{CaCO_3}=\dfrac{10}{100}=0,1\:mol\)
\(PTHH:\:CaCO_3+2HCl\rightarrow CaCl_2+H_2O+CO_2\uparrow\)
\(n_{HCl}=\dfrac{0,1.2}{1}=0,2\:mol\)
\(\Rightarrow m_{HCl}=0,2.36,5=7,3g\)

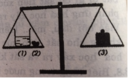
Sau khi phản cho (1) với (2) vào nhau xảy ra phản ứng
HCl + CaCO3 → CaCl2 + CO2 + H2O
Vì khí CO2 bị thoát ra nên khối lượng của bên cân chứa (1), (2) bị giảm xuống, cân nghiêng về phía có quả cân (3).

Theo đề bài ta có : nCaCO3 = \(\dfrac{10}{100}=0,1\left(mol\right)\)
a) Ta có PTHH :
CaCO3 + 2HCl \(\rightarrow\) CaCl2 + H2O + CO2\(\uparrow\)
0,1mol....0,2mol..........0,1mol
b) Ta có :
\(m_{\text{dd}HCl}=\dfrac{\left(0,2.36,5\right).100\%}{20\%}=36,5\left(g\right)\)
=> \(V_{\text{dd}HCl}=\dfrac{m}{D}=\dfrac{36,5}{1,1}\approx33,182\left(ml\right)\)
c) Khối lượng muối thu được là : mCaCl2 = 0,1.111 = 11,1 (g)
Vậy............

Chọn B. Vì khi cho đá vôi vào dung dịch axit clohiric có phản ứng sinh ra khí cacbon dioxit thoát ra ngoài làm cho khối lượng sẽ giảm đi.

a)
\(n_{Zn}=\dfrac{13}{65}=0,2\left(mol\right)\)
PTHH: Zn + 2HCl --> ZnCl2 + H2
0,2-->0,4------>0,2--->0,2
=> VH2 = 0,2.22,4 = 4,48 (l)
b) mHCl(PTHH) = 0,4.36,5 = 14,6 (g)
=> \(m_{HCl\left(tt\right)}=\dfrac{14,6.120}{100}=17,52\left(g\right)\)
c)
\(n_{O_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: 2H2 + O2 --to--> 2H2O
Xét tỉ lệ: \(\dfrac{0,2}{2}< \dfrac{0,2}{1}\) => H2 hết, O2 dư
PTHH: 2H2 + O2 --to--> 2H2O
0,2--->0,1------->0,2
=> mH2O = 0,2.18 = 3,6 (g)
mO2(dư) = (0,2 - 0,1).32 = 3,2(g)
nZn = 13/65 = 0,2 (mol)
PTHH: Zn + 2HCl -> ZnCl2 + H2
Mol: 0,2 ---> 0,4 ---> 0,2 ---> 0,2
VH2 = 0,2 . 22,4 = 4,48 (l)
mHCl = (0,4 . 36,5)/(100% + 20%) = 73/6 (g)
nO2 = 4,48/22,4 = 0,2 (mol)
PTHH: 2H2 + O2 -> (t°) 2H2O
LTL: 0,2/2 < 0,2 => O2 dư
nH2O = nH2 = 0,2 (mol)
mH2O = 0,2 . 18 = 3,6 (g)

\(a,\text{Sơ đồ p/ứ: }Fe+HCl\to FeCl_2+H_2\\ b,PTHH:Fe+2HCl\to FeCl_2+H_2\\ c,\text{Bảo toàn KL: }m_{Fe}+m_{HCl}=m_{FeCl_2}+m_{H_2}\\ \Rightarrow m_{HCl}+56=150+8=158\\ \Rightarrow m_{HCl}=102(g)\)

Bảo toàn KL: \(m_{Fe}+m_{HCl}=m_{FeCl_2}+m_{H_2}\)
\(\Rightarrow m_{FeCl_2}=5,6+7,3-0,2=12,7(g)\)

Zn + 2HCl ---> ZnCl2 + H2
0.2-→0.4------→0.2--→0.2 (mol)
nZn = 11,2\56 = 0.2(mol)
mZnCl2 = n*M = 0.2*127 = 25.4(g)
VH2(đktc) = n*22.4 = 0.2*22.4 = 4.48(l)
mHCl = n*M = 0.4*36.5 = 14.6(g)
C% =14,6\146*100% = 10(%)
\(a.Zn+2HCl\rightarrow ZnCl_2+H_2\\ b.n_{Zn}=\dfrac{11,2}{65}=0,17\left(mol\right)\\ TheoPT:n_{ZnCl_2}=n_{H_2}=n_{Zn}=0,17\left(mol\right)\\ m_{ZnCl_2}=0,17.136=23,12\left(g\right)\\ V_{H_2}=0,17.22,4=3,808\left(l\right)\\ c.n_{HCl}=2n_{Zn}=0,34\left(mol\right)\\ C\%_{HCl}=\dfrac{0,34.36,5}{146}.100=8,5\%\)
\(n_{CaO}=\dfrac{11.2}{56}=0.2\left(mol\right)\)
\(CaO+2HCl\rightarrow CaCl_2+H_2O\)
\(0.2..........0.4.........0.2\)
\(C_{M_{HCl}}=\dfrac{0.4}{0.1}=4\left(M\right)\)
\(m_{CaCl_2}=0.2\cdot111=22.2\left(g\right)\)