Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) $Al_2O_3 + 6HCl \to 2AlCl_3 + 3H_2O$
b) $n_{Al_2O_3} = \dfrac{15,3}{102} = 0,15(mol)$
$\Rightarrow n_{AlCl_3} =0,15.2 = 0,3(mol)$
$m_{AlCl_3} =0,3.133,5 = 40,05(gam)$
c) $n_{HCl}= 6n_{Al_2O_3} = 0,9(mol)$
$C_{M_{HCl}} = \dfrac{0,9}{0,3} = 3M$
Số mol của nhôm oxit
nAl2O3= \(\dfrac{m_{Al2O3}}{M_{Al2O3}}=\dfrac{15,3}{102}=0,15\left(mol\right)\)
a) Pt : Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O\(|\)
1 3 1 3
0,15 0,45 0,15
b) Số mol của muối nhôm sunfat
nAl2(SO4)3 = \(\dfrac{0,15.1}{1}=0,15\left(mol\right)\)
Khối lượng của muối nhôm sunfat
mAl2(SO4)3 = nAl2(SO4)3 . MAl2(SO4)3
= 0,15 . 342
= 51,3 (g)
c) Số mol của axit sunfuric
nH2SO4 = \(\dfrac{0,15.3}{1}=0,45\left(mol\right)\)
300ml = 0,3l
Nồng độ mol của axit sunfuric đã phản ứng
CMH2SO4 = \(\dfrac{n}{V}=\dfrac{0,45}{0,3}=1,5\left(M\right)\)
Chúc bạn học tốt

a)\(n_{Fe}=\dfrac{14}{56}=0,25\left(mol\right)\)
PTHH: Fe + 2HCl → FeCl2 + H2
Mol: 0,25 0,5 0,25
b) \(C_{M_{ddHCl}}=\dfrac{0,5}{0,5}=1M\)
c) \(V_{H_2}=0,25.22,4=5,6\left(l\right)\)

PTHH: \(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
\(FeCl_2+2NaOH\rightarrow Fe\left(OH\right)_2\downarrow+2NaCl\)
Ta có: \(n_{Fe\left(OH\right)_2}=\dfrac{18}{90}=0,2\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{NaOH}=0,4\left(mol\right)\\n_{H_2}=0,2\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}V_{H_2}=0,2\cdot22,4=4,48\left(l\right)\\C\%_{NaOH}=\dfrac{0,4\cdot40}{160}\cdot100\%=10\%\end{matrix}\right.\)

Gọi x, y lần lượt là sô mol của Fe và Mg
Ta có: \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH:
Fe + H2SO4 ---> FeSO4 + H2 (1)
Mg + H2SO4 ---> MgSO4 + H2 (2)
a. Theo PT(1): \(n_{H_2}=n_{Fe}=x\left(mol\right)\)
Theo PT(2): \(n_{H_2}=n_{Mg}=y\left(mol\right)\)
\(\Rightarrow x+y=0,3\) (*)
Theo đề, ta có: 56x + 24y = 10.4 (**)
Từ (*) và (**), ta có HPT:
\(\left\{{}\begin{matrix}x+y=0,3\\56x+24y=10,4\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,1\\y=0,2\end{matrix}\right.\)
\(\Rightarrow m_{Fe}=0,1.56=5,6\left(g\right);m_{Mg}=0,2.24=4,8\left(g\right)\)
b. Ta có: \(n_{hh}=0,1+0,2=0,3\left(mol\right)\)
Theo PT(1,2): \(n_{H_2SO_4}=n_{hh}=0,3\left(mol\right)\)
Đổi 200ml = 0,2 lít
\(\Rightarrow C_{M_{H_2SO_4}}=\dfrac{0,3}{0,2}=1,5M\)

a) \(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
\(m_{H_2SO_4}=147.10\%=14,7\left(g\right)\Rightarrow n_{H_2SO_4}=\dfrac{14,7}{98}=0,15\left(mol\right)\)
PTHH: Zn + H2SO4 → ZnSO4 + H2
Mol: 0,1 0,1 0,1 0,1
Ta có: \(\dfrac{0,1}{1}< \dfrac{0,15}{1}\) ⇒ Zn hết, H2SO4 dư
b) \(V_{H_2}=0,1.22,4=2,24\left(l\right)\)
c) mdd sau pứ = 6,5 + 147 - 0,1.2 = 153,3 (g)
\(C\%_{ddZnSO_4}=\dfrac{0,1.161.100\%}{153,3}=10,502\%\)
\(C\%_{ddH_2SO_4dư}=\dfrac{\left(0,15-0,1\right).98.100\%}{153,3}=3,196\%\)

Tìm số mol H2SO4 có trong dung dịch :
n H 2 SO 4 = n H 2 = 0,15 mol, tính ra C M H 2 SO 4 = 3M.
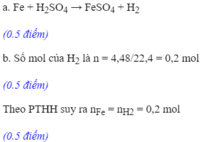

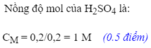
Ta có: \(n_{Fe}=\dfrac{14}{56}=0,25\left(mol\right)\)
a. \(PTHH:Fe+H_2SO_4--->FeSO_4+H_2\uparrow\)
b. Theo PT: \(n_{H_2}=n_{Fe}=n_{H_2SO_4}=0,25\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,25.22,4=5,6\left(lít\right)\)
c. Ta có: \(m_{H_2SO_4}=0,25.98=24,5\left(g\right)\)
\(\Rightarrow C_{\%_{H_2SO_4}}=\dfrac{24,5}{486,5}.100\%=5,04\%\)