Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)\(\left\{{}\begin{matrix}n_{Cu}=x\left(mol\right)\\n_{Al}=y\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}64x+27y=9,1\\BTe:2x+3y=0,5\cdot1\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}x=0,1\\y=0,1\end{matrix}\right.\)
\(\%m_{Cu}=\dfrac{0,1\cdot64}{9,1}\cdot100\%=70,33\%\)
\(\%m_{Al}=100-70,33\%=29,67\%\)
b)\(\left\{{}\begin{matrix}n_{NO_2}+n_{NO}=0,5\\\dfrac{n_{NO_2}}{n_{NO}}=\dfrac{2}{1}\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}n_{NO_2}=\dfrac{1}{3}\\n_{NO}=\dfrac{1}{6}\end{matrix}\right.\)
Gọi \(\left\{{}\begin{matrix}n_{Cu}=a\left(mol\right)\\n_{Al}=b\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}64a+27b=9,1\\BTe:2x+3y=\dfrac{1}{3}\cdot1+\dfrac{1}{6}\cdot3\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}a=\dfrac{4}{115}\\b=\dfrac{527}{2070}\end{matrix}\right.\)
\(\%m_{Cu}=\dfrac{\dfrac{4}{115}\cdot64}{9,1}\cdot100\%=24,46\%\)
\(\%m_{Al}=100\%-24,46\%=75,54\%\)
\(n_{HNO_3}=2n_{NO_2}+4n_{NO}=2\cdot\dfrac{1}{3}+4\cdot\dfrac{1}{6}=\dfrac{4}{3}mol\)

\(\text{Đ}\text{ặt}:n_{Mg}=a\left(mol\right);n_{Al}=1,5a\left(mol\right)\\ \Rightarrow24a+27.1,5a=12,9\\ \Leftrightarrow a=0,2\left(mol\right)\\\Rightarrow n_{Mg}=0,2\left(mol\right);n_{Al}=0,3\left(mol\right)\\ 2Al+3Cl_2\rightarrow\left(t^o\right)2AlCl_3\\ Mg+Cl_2\rightarrow\left(t^o\right)MgCl_2\\ n_{AlCl_3}=n_{Al}=0,3\left(mol\right);n_{MgCl_2}=n_{Mg}=0,2\left(mol\right)\\ m_{mu\text{ố}i}=m_{MgCl_2}+m_{AlCl_3}=95.0,2+0,3.133,5=59,05\left(g\right)\)
Đây là bài 1
B2:
\(n_{H_2}=0,4\left(mol\right)\\ n_{Cl_2}=0,45\left(mol\right)\\ \text{Đ}\text{ặt}:n_{Al}=x\left(mol\right);n_{Fe}=y\left(mol\right)\left(x,y>0\right)\\ 2Al+6HCl\rightarrow2AlCl_3+3H_2\\ Fe+2HCl\rightarrow FeCl_2+H_2\\ 2Al+3Cl_2\rightarrow\left(t^o\right)2AlCl_3\\ 2Fe+3Cl_2\rightarrow\left(t^o\right)2FeCl_3\\ \Rightarrow\left\{{}\begin{matrix}1,5x+y=0,4\\1,5x+1,5y=0,45\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,2\\y=0,1\end{matrix}\right.\\ \Rightarrow m=m_{Al}+m_{Fe}=27x+56y=27.0,2+56.0,1=11\left(g\right)\)

Gọi số mol Zn là a (mol)
\(n_{NO_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\); \(n_{NO}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
\(Zn^0-2e\rightarrow Zn^{+2}\)
a----->2a________________(mol)
\(N^{+5}+1e\rightarrow N^{+4}\)
_____0,3<---0,3___________(mol)
\(N^{+5}+3e\rightarrow N^{+2}\)
_____0,3<---0,1___________(mol)
THEO ĐLBT e: 2a = 0,6
=> a = 0,3 (Mol)
=> m = 0,3.65 = 19,5(g)

Đặt x, y, z lần lượt là số mol Cu, Mg, Al.
Quá trình nhường e :
Cu → Cu 2 + + 2e
x → x → 2x
Mg → Mg 2 + + 2e
y → y → 2y
Al → Al 3 + + 3e
z → z → 3z
Quá trình thu e :
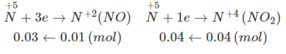
Ta có : 2x + 2y + 3z = 0,03 + 0,04 = 0,07 và 0,07 cũng chính là số mol NO 3 - tạo muối.
Khối lượng muối nitrat là : 1,35 + 62 × 0,07 = 5,69 (gam).



1. a. dd KI xuất hiện màu đỏ tím, sau đó dần trở lại không màu
Cl2 + 2KI \(\rightarrow\) 2KCl + I2 và 5Cl2 + I2 + 6H2O \(\rightarrow\) 2HIO3 + 10HCl
b. Quá trình chuyển X2 \(\rightarrow\) 2X- phụ thuộc vào 2 yếu tố: năng lượng phân li phân tử thành nguyên tử (tức năng lượng liên kết) và ái lực e để biến nguyên tử X thành ion X-
Mặc dù ái lực của flo bé hơn clo, nhưng năng lượng liên kết của flo lại thấp hơn của clo nên flo dễ phân li thành nguyên tử hơn, vì vậy tính oxi hóa của flo mạnh hơn clo
(Năng lượng liên kết của flo thấp hơn clo vì: Trong phân tử F chỉ có các AO p, không có AO trống \(\rightarrow\) phân tử F2 chỉ có liên kết \(\sigma\). Trong nguyên tử Cl, ngoài các AO p còn có AO d trống \(\rightarrow\) phân tử Cl2 ngoài sự xen phủ các AO p để tạo liên kết \(\sigma\), thì mây e còn đặt vào AO d trống, do đó tạo một phần liên kết pi).
2. Dựa vào thể tích và khối lượng hỗn hợp khí, lập hệ pt dễ dàng tính được số mol SO2 = 0,06 và NO2 = 0,02 \(\rightarrow\) số mol e nhận = 0,06.2 + 0,02 = 0,14
Nếu tất cả kim loại đều tan thì ne nhường = 0,03.3 + 0,02.2 + 0,02.2 = 0,17 > 0,14. Như vậy có kim loại còn dư, đó là Cu (vì Cu có tính khử yếu nhất), tính được số mol Cu dư = \(\frac{0,17-0,14}{2}\) = 0,015
Ta có : NO3- + 2H+ +1e \(\rightarrow\) NO2 + H2O
0,02 0,04
SO42- +4H+ +2e \(\rightarrow\) SO2 +2H2O
0,06 0,24
nNO3 -(muối) = nNO3- (ax) – nNO2 = nH+ - nNO2 = 0,04 – 0,02 = 0,02
Tương tự tính được nSO42- = 0,06 mol. Khối lượng muối = mkim loại + mgốc axit
\(\rightarrow\) m = 0,03.27 + 0.02.65 + 0,005.64 + 0,02.62 + 0,06.96 = 9,43 (gam)